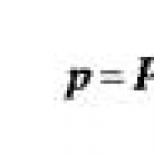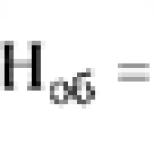Syndróm endogénnej intoxikácie závažnosti. Endogénna intoxikácia tela. Príčiny endogénnej otravy
Koncept endogénnej intoxikácie.
Hlavné typy endotoxikózy u chirurgických pacientov
Všeobecné klinické a laboratórne príznaky endotoxikózy
Kritériá závažnosti endogénnej intoxikácie na chirurgickej klinike.
Princípy liečby endotoxikózy
Odstránenie hypoxie tkaniva
Umelé odstraňovanie toxických produktov z tela
Základné metódy mimotelovej detoxikácie.
Koncept endogénnej intoxikácie.
Syndróm endogénnej intoxikácie (SEI) sa chápe ako komplex symptómov spôsobených akumuláciou endotoxínov v tkanivách a biologických tekutinách.
Endotoxikóza - akumulácia toxických metabolitov vo vysokých koncentráciách v tkanivách a biologických tekutinách (krv, lymfa, cerebrospinálny mok).
Endotoxémia je hromadenie toxických metabolitov v krvi.
Hlavné typy endotoxikózy u chirurgických pacientov
Traumatická endotoxikóza- nastáva, keď sa telo uvoľní z kompresie a absorpcie produktov autolýzy rozdrvených tkanív do krvi obete.
Ischemická endotoxikóza- porušenie dodávky kyslíka do tkanív, oxidačné substráty, odstraňovanie produktov metabolizmu tkanív.
Infekčno-zápalová endotoxikóza- vznik lokálneho infekčno-zápalového ložiska ako hlavného zdroja endogénnej intoxikácie.
Metabolická endotoxikóza– na pozadí vysokej aktivity zdroja tvorby toxických látok sa prirodzené detoxikačné mechanizmy ukazujú ako nedokonalé.
Dishormonálna endotoxikóza- zvýšené uvoľňovanie hormónov patologicky zmenenými orgánmi vnútornej sekrécie.
Všeobecné klinické a laboratórne príznaky endotoxikózy
Klinické hodnotenie endotoxikózy:
CNS- excitácia alebo útlak vedomia. Detekcia patológie CNS nevyžaduje žiadne špeciálne metódy.
Pri ťažkých stupňoch endotoxikózy majú pacienti hlbokú mentálnu strnulosť (stupor alebo kóma).
Pri menej závažnej intoxikácii u pacientov omráčenie, delírium, omráčenie za súmraku.
Hemodynamické poruchy
Tachykardia pri absencii straty krvi, závažné poškodenie vonkajšieho dýchania je jedným zo znakov endogénnej intoxikácie.
Pri tachykardii 120 za minútu. a väčšia tachykardia je sprevádzaná poklesom krvného tlaku. Srdcové ozvy sú tlmené, EKG ukazuje difúzne svalové zmeny. Potom sa vyvinú poruchy mikrocirkulácie: bledosť a mramorovanie kože.
Poruchy vo vonkajšom dýchacom systéme
Pri absencii poranenia hrudníka alebo masívnej pneumónie sa v dôsledku rozvíjajúcej sa hypoxie tkaniva vyvinie akútne respiračné zlyhanie. Pľúca sú jedným z prvých cieľových orgánov, ktoré sú poškodené.
Poruchy mikrocirkulácie
Zvýšenie obsahu biologicky aktívnych látok v krvi, ktoré ovplyvňujú tonus a priepustnosť krvných ciev (histamín).
Zvýšenie obsahu látok, ktoré poškodzujú a narúšajú syntézu pľúcneho surfaktantu (endotoxíny, stredne ťažké molekuly, produkty peroxidácie lipidov).
Akútne respiračné zlyhanie sa prejavuje dýchavičnosťou a znížením saturácie.
Akútna hepato-renálna insuficienciačasto dôsledkom porúch mikrocirkulácie.
Poruchy vody a elektrolytov
Prejavy dehydratácie (suchosť a znížený turgor kože, vymiznutie reliéfu saphenóznych žíl, retrakcia očných bulbov, smäd, suchosť jazyka).
Strata vody (peritonitída, akútna črevná obštrukcia, infekčné a zápalové procesy inej lokalizácie, sprevádzané exsudáciou a hypertermiou)
Iné typy endotoxikózy u chirurgických pacientov (stimulácia prirodzených detoxikačných mechanizmov: endogénna hemodilúcia a intersticiálny edém v oblasti zápalového procesu)
Poruchy termoregulácie
Hypertermia, v kritickom stave hypotermia
Znížená gastrointestinálna motilita
Laboratórne vyšetrenie endotoxikózy:
Leukocytóza, posun leukocytový vzorec vľavo, toxická zrnitosť neutrofilov
Pri ťažkej endotoxikóze sa leukocytóza zvyšuje v periférnej krvi s tendenciou k veľmi vysokým číslam - 25-30∙10 9 . Vzorec leukocytov sa mení v dôsledku zvýšenia počtu neutrofilov (bodnutie a myelocyty). Takáto zmena vo vzorci leukocytov sa nazýva posun doľava. Neutrofília naznačuje aktivitu zápalového procesu, eozinofília - o relatívnej nedostatočnosti funkcie nadobličiek, lymfopénia - o stave imunitnej depresie.
ESR zrýchlenie
Zníženie obsahu celkových bielkovín v krvi
Hyperfermentémia (zvýšené hladiny ALT a AST v krvi)
Zvýšenie obsahu bilirubínu v krvi
Hyperazotémia (zvýšené hladiny močoviny a kreatinínu v krvi)
Znížené ukazovatele bunkovej a humorálnej imunity.
Markery endotoxémie:
Stredné molekuly (SM, c.u.), norma do 0,2 c.u.
Medzi stredné molekuly patria lyzozomálne enzýmy, produkty proteolýzy a oligopeptidy. Za hlavný zdroj ich tvorby sa považuje zvýšenie katabolizmu a neenzymatickej proteolýzy vrátane krvných bielkovín. Inhibujú erytropoézu, inhibujú glukoneogenézu a syntézu DNA, majú cytotoxický účinok, spôsobujú poruchy mikrocirkulácie.
Leukocytový index intoxikácie (LII, c.u.), norma 1,0-1,4
LII pre Kalf-Kalif:
LII \u003d (4 mes. + 3. jun + 2 pal. + segm) × (plazma + 1) / (mon + limf) × (eos + 1)
Plazmatické bunky v malom množstve sa môžu objaviť pri akomkoľvek infekčnom a zápalovom procese, pri malígnych novotvaroch.
Proteolytická aktivita krvného séra (PA, min.), Normálna do 4
Cirkulujúce imunitné komplexy (CIC, jednotky), norma do 40
Peroxidácia lipidov (LPO), zvýšenie.
KONCEPCIA A KLASIFIKÁCIA ENDOTOXIKÓZY,
ENDOGÉNA INOXIKÁCIA
A ENDOGÉNNE TOXICKÉ LÁTKY
Typická je endotoxikóza patologický proces, čo je štrukturálna a funkčná odpoveď organizmu na toxickú agresiu endogénneho aj exogénneho charakteru. Z užšieho praktického hľadiska ju možno charakterizovať ako klinický prejav endogénnej intoxikácie, ktorý nie je obmedzovaný mechanizmami adaptácie a kompenzácie toxických informácií.
Rozlišovať
- akútna endotoxikóza [šou]
.
Pri akútnej endotoxikóze endogénna intoxikácia stabilne progreduje napriek rozvoju a napätiu kompenzačných mechanizmov (obsah a rozsah ETS sa progresívne zvyšuje), čo vedie k dysregulácii homeostázy, k vzniku syndrómu zlyhania viacerých orgánov, dezintegrácii telesných funkcií a často k smrť.
- subakútna endotoxikóza [šou]
.
Subakútnu (predĺženú) endotoxikózu možno považovať za variant akútnej endotoxikózy, ktorá je charakteristická pomaly (počas niekoľkých dní alebo dokonca týždňov) progresívneho patologického stavu. Kompenzačné reakcie dlho brániť jej progresiu. Neskôr, v neprítomnosti účinnú liečbu, dochádza k poruche kompenzačných mechanizmov a rýchlemu rozvoju zle korigovaných metabolických porúch, ktoré spravidla vedú k smrti.
- chronická endotoxikóza [šou]
.
Chronická endotoxikóza- ide o patologický proces, pri ktorom sa vďaka rozvoju kompenzačných mechanizmov dosahuje udržanie homeostázy a následne životaschopnosti organizmu. K fatálnym poruchám homeostázy nedochádza, ale nadmerná činnosť detoxikačných systémov dlhodobo vedie k ich postupnému vyčerpaniu a zníženiu odolnosti a reaktivity organizmu na škodlivé faktory prostredia. Chronická endotoxikóza môže existovať mnoho rokov. Jeho prejavy sú rôznorodé a majú špecifickosť v dôsledku ochorenia, ktoré ho spôsobilo.
Endogénna intoxikácia (EnI) existuje polyetiologický a polypatogenetický syndróm charakterizovaný akumuláciou endogénnych toxických látok (ETS) v tkanivách a biologických tekutinách – nadbytok produktov normálneho alebo zvráteného metabolizmu alebo bunkovej odpovede. Ide o komplexný viaczložkový jav, ktorý zahŕňa:
- zdroj toxémie, poskytujúci tvorbu ETS;
- biologické bariéry, ktoré bránia prieniku endogénnych toxínov za zdroj;
- mechanizmy prenosu týchto toxických produktov do cieľových buniek, do orgánov biotransformácie a/alebo vylučovania;
- mechanizmy imobilizácie a depozície, biotransformácie (neutralizácie) a vylučovania toxických produktov;
- efektorové reakcie na intoxikáciu vo forme takzvanej sekundárnej toxickej agresie, v dôsledku ktorej ENI do značnej miery stráca svoju špecifickosť.
Hoci je endogénna intoxikácia polyetiologická, možno rozlíšiť tieto hlavné primárne mechanizmy jej vývoja:
- produkcia alebo výmena spôsobená nadmernou produkciou endogénnych toxických látok (difúzna peritonitída, akútna pankreatitída, akútna pneumónia);
- resorpčné, keď sa toxické látky resorbujú z obmedzeného ohniska infekcie, rozpadajúcich sa tkanív (črevná obštrukcia, flegmóna mäkkých tkanív, abscesy atď.);
- reperfúzia, pri ktorej sa do systémového krvného obehu dostávajú látky, ktoré sa nahromadili v dlhodobo ischemických tkanivách a zároveň sa z buniek týchto tkanív uvoľňujú pri ich poškodení aktívnym kyslíkom a prebytkom voľných radikálov na pozadí zlyhania antioxidačnej obrany (šok, reperfúzny syndróm, operácie s použitím prístroja srdce-pľúca atď.);
- retencia, pri ktorej dochádza k akumulácii ETS v dôsledku narušenia ich vylučovania prirodzenými detoxikačnými orgánmi (akútna renálna (AR) a hepatálna (AKI) insuficiencia);
- infekčné, v dôsledku vstupu mikroorganizmov, ich metabolických produktov a rozpadu z ohniska invazívnej infekcie alebo translokáciou z perverzne kontaminovaného gastrointestinálneho traktu.
Na vzniku akútnej endotoxikózy sa môže súčasne alebo postupne podieľať viacero mechanizmov vzniku ETS a ich akumulácie vo vnútornom prostredí organizmu.
Otázka, čo môžu byť také toxické látky a určiť závažnosť stavu pacienta, je zložitá a kontroverzná, pretože mnohé látky môžu mať v závislosti od koncentrácie priaznivé aj nepriaznivé funkčné účinky a väčšina z nich nebola vôbec identifikovaná. . Môžete sa ich pokúsiť klasifikovať v závislosti od etiológie [šou] a mechanizmus vylučovania [šou] .
Rozdelenie ETS podľa mechanizmu vzniku
- produkty normálneho metabolizmu vo vysokých koncentráciách (laktát, pyruvát, kyselina močová, močovina, kreatinín, bilirubín-glukuronid atď.);
- látky, ktoré sa nadmerne tvoria pri zvrátenom metabolizme (ketóny, aldehydy, alkoholy, karboxylové kyseliny, amoniak atď.);
- produkty rozkladu buniek a tkanív z ložísk deštrukcie tkaniva a / alebo z gastrointestinálneho traktu pri porušení bariérových funkcií membrán (lipázy, lyzozomálne enzýmy, katiónové proteíny, myoglobín, indol, skatol, fenol atď.);
- zložky a efektory regulačných systémov tela v patologických koncentráciách;
- aktivované enzýmy (lyzozomálne, proteolytické, aktivačné produkty kalikreín-kinínovej kaskády, systémy zrážania krvi a fibrinolýzy);
- zápalové mediátory, biogénne amíny, cytokíny, prostaglandíny, leukotriény, proteíny akútnej fázy a iné biologicky aktívne látky;
- aktívne zlúčeniny vytvorené počas peroxidácie lipidov;
- mikrobiálne toxíny (exo- a endotoxíny) a iné faktory patogenity mikroorganizmov (patogénne, podmienene patogénne, nepatogénne);
- imunocudzie produkty bunkového rozpadu, antigény a imunokomplexy-agresory.
Rozdelenie ETS podľa mechanizmu vylučovania
- plynné látky – vylučujú sa cez pľúca;
- hydrofilné nízko- a strednomolekulárne látky – odstraňujú sa obličkami, cez kožu, gastrointestinálny trakt vo forme roztokov;
- hydrofóbne látky s nízkou a strednou molekulovou hmotnosťou sú transportované bielkovinami a/alebo krvinkami do pečene a pľúc, kde sú biotransformované za účasti monooxygenázového systému alebo podliehajú zmenám väzbových reakcií s následným odstránením obličkami, pokožkou, gastrointestinálnym traktom ;
- hydrofóbne látky s nízkou a strednou molekulovou hmotnosťou - viažu sa na proteíny krvnej plazmy, získavajú vlastnosti hapténov a sú absorbované bunkami imunitného systému;
- makromolekulárne zlúčeniny – sú eliminované systémom monocytov-makrofágov (až 80 % makrofágov organizmu sa nachádza v pečeni).
Akútna endotoxikóza prebieha ako kaskádový proces. Jeho rozvoj a progresia je spojená s nesúladom medzi tvorbou (príjmom a pod.) toxických látok, vrátane tých, ktoré vznikajú následkom toxickej autoagresie, a schopnosťou orgánov zaradených do funkčného detoxikačného systému (pľúca, pečeň, obličky, gastrointestinálny trakt, koža, imunologický dohľadový systém), transformovať, neutralizovať a eliminovať. Zásadné môžu byť porušenia pomerov medzi antagonistickými látkami v humorálnych regulačných systémoch (enzýmy-antienzýmy, oxidanty-antioxidanty, cytokíny-anticytokíny atď.).
Na základe vzťahu endogénnej intoxikácie a možností funkčný systém detoxikácii (FSD), možno rozlíšiť 4 štádiá vývoja endotoxikózy (tab. 16.1 [šou] ).
V štádiu kompenzácie FSD úplne kompenzuje toxemickú záťaž. V štádiu stresu sa rýchlosť produkcie toxických látok zhoduje s maximálnymi možnosťami FSD. V štádiu subkompenzácie produkcia toxických látok rozhodne presahuje možnosti FSD. A napokon v štádiu dekompenzácie sa rozvinie zlyhanie orgánov FSD a objavia sa život ohrozujúce metabolické a funkčné poruchy.
Koncentrácia akéhokoľvek ETS v konkrétnej klinickej situácii odráža výslednú rýchlosť tvorby tejto látky, rýchlosť jej akumulácie a distribúcie v zásobách tkanív a bunkových membrán a rýchlosť jej biotransformácie alebo eliminácie hlavnými a doplnkovými spôsobmi ( Obr. 16.1).
Na určenie taktiky liečby a výber optimálneho programu intenzívnej starostlivosti pre endotoxikózu je potrebné zistiť nielen fakt toxémie a intoxikácie, ktorý je zvyčajne zjavný v akútnych a subakútnych prípadoch, ale aj stanoviť diagnózu závažnosti sekundárnych toxická autoagresia. Pokus spoliehať sa pri riešení týchto problémov len na markery intoxikácie, ako je štúdium obsahu xenobiotík, alebo na štúdium konečných a medziproduktov metabolizmu v telesných tekutinách – v krvnej plazme, lymfe, likvore – nie je dostatočne informatívny. Takáto štúdia nepochybne poskytuje informácie o primárnom účinku intoxikácie, orientuje sa v jej zdrojoch a mechanizmoch, no v praxi to vždy nestačí na určenie smeru a celého liečebného programu. Úplnejší obraz sa vytvára pri zvažovaní endotoxikózy z pohľadu rovnováhy endogénnej intoxikácie a možností FSD.
Všetky tieto prístupy je možné implementovať do praktickej činnosti laboratórnej služby, ktorá zabezpečuje každodennú činnosť blokov a oddelení resuscitačnej a intenzívnej medicíny, izieb, oddelení a centier pre mimotelové hemokorekcie.
Domnievame sa, že je potrebné rozlišovať laboratórne kritériá niekoľkých úrovní:
- markery akútnej otravy alebo endogénnej intoxikácie, ak sú v tejto klinickej situácii jasne definované;
- laboratórne kritériá charakterizujúce sekundárnu toxickú autoagresiu, zamerané na hodnotenie reakcie organizmu pacienta na primárnu a sekundárnu intoxikáciu, ako aj umožňujúce určiť dynamiku toxicity zložiek vnútorného prostredia a štádium endotoxikózy;
- ukazovatele charakterizujúce prácu FSD, orgánov a systémov podpory života tela.
Zároveň je dôležité zhodnotiť vplyv najaktívnejšieho detoxikačného účinku, ktorý môže byť často dodatočným stresovým faktorom, niekedy až agresívnym. Dostatočne časté a rýchle získavanie týchto parametrov je hlavnou podmienkou operatívnej lekárskej kontroly počas intenzívnej starostlivosti. Algoritmus hodnotenia takýchto ukazovateľov je uvedený v tabuľke. 16.2 [šou] .
| Tabuľka 16.2. Algoritmus na diagnostiku akútnej endotoxikózy | |
| Ukazovatele | Účel štúdie |
| Indikátory charakterizujúce počiatočnú toxémiu | Zistite prítomnosť výraznej intoxikácie a prípadne získajte informácie o jej zdroji |
| Markery sekundárnej toxickej autoagresie: Skupina markerov intoxikácie a indikátorov integrálnej toxicity biologických tekutín (krv, lymfa, moč, sliny, mozgovomiechový mok) | Integrálne hodnotenie závažnosti endogénnej intoxikácie |
| Ukazovatele charakterizujúce rovnováhu humorálnych regulačných systémov | Odhaliť porušenia pomerov medzi látkami-antagonistami |
| Ukazovatele charakterizujúce fungovanie orgánov a systémov, predovšetkým funkčného detoxikačného systému | Zistite, ktoré životne dôležité orgány sú ovplyvnené a aké sú funkčné rezervy zvyšku |
| Základné (organizmické) klinické, funkčné a laboratórne parametre | Ukážte, či primárna toxinémia a endotoxikóza ohrozuje existenciu organizmu a ako sa prejavuje |
DIAGNOSTIKA POČIATOČNEJ TOXINEMIE
Úplné informácie možno poskytnúť len niekedy kvantifikácia endogénna toxická látka - špecifický marker tejto formy endogénnej intoxikácie, čo však nie je vždy absolútnym kritériom počiatočnej toxémie.
Stanovenie hladiny laktátu v krvi na pozadí kritického stavu tela pacienta a hyperglykémie nám umožňuje posúdiť závažnosť laktátovej acidózy, ale iba jej porovnanie s inými ukazovateľmi metabolizmu uhľohydrátov nám umožňuje pripísať tento jav posthypoxickej acidóze alebo mliečnej acidóze. acidóza ako prejav kritickej dekompenzácie cukrovka. Ďalšou možnosťou potvrdzujúcou prítomnosť diabetogénneho charakteru endogénnej intoxikácie je stanovenie ketolátok, najmä ak koreluje s údajmi zo štúdia acidobázického stavu krvi a úrovne osmolarity.
Pri hodnotení hĺbky ENI pri obštrukčnej žltačke sa možno zamerať na hladinu krvného bilirubínu, ktorá koreluje so závažnosťou duševných porúch a závažnosťou hepatocelulárnej inkompetencie. V mnohých prípadoch však informácie iba o úrovni a dynamike hyperbilirubinémie zjavne nestačia na diagnostiku endotoxikózy na pozadí zlyhania pečene.
Neustále zvyšovanie plazmatickej hladiny draslíka (hyperkaliémia nad 6 mmol/l) naznačuje nebezpečenstvo jeho ďalšej retencie v organizme s rozvojom kritického stavu a životná nevyhnutnosť aktívna detoxikácia. To by malo upútať pozornosť najmä vtedy, ak je močenie výrazne obmedzené a na EKG sa zisťujú príznaky hyperkaliémie.
Vysoká hladina dusíkatých odpadov v krvi (zvyškový dusík, močovina, kyselina močová) umožňuje spájať vznik počiatočnej toxémie s poškodením obličiek a zadržiavaním týchto toxických látok, aj keď produkčným mechanizmom vzniku azotémie je tiež možné. Zvyčajne na pozadí mnohých variantov ENI existuje kombinácia týchto dvoch mechanizmov. Musíme rozšíriť štúdiu, aby sme mohli posúdiť prevládajúcu povahu tejto poruchy: spolu s močovinou skúmať zvyškový dusík v krvi a tiež určiť index štiepenia, to znamená podiel polypeptidov v celkovej zásobe zvyškového dusíka. . Normálne je index štiepenia 0,16-0,24; pri produkčnej azotémii sa zvyšuje o viac ako 0,32. Možný je aj čisto retenčný charakter azotémie, ktorý je spojený s poruchami elektrolytov vo forme chlórovanej azotémie. Zvyčajne sa pozoruje pri hypochloremickej hypokalemickej alkalóze, ktorá si navyše vyžaduje stanovenie koncentrácie chlóru a bikarbonátových iónov v krvnej plazme a v extracelulárnej tekutine.
Stanovením aktivity pankreatických enzýmov v krvnom sére, najmä proteináz a lipáz a ich inhibítorov, možno charakterizovať hladinu enzýmovo-produktívneho ENI pri deštruktívnej pankreatitíde. V tomto prípade má miesto odberu krvi na výskum určitú hodnotu. Ak si predstavíme význam pľúc ako detoxikačného orgánu, najviac informácií o markeroch tohto typu ENI môže poskytnúť zmiešaná venózna krv (z centrálnej žily alebo pravej predsiene), ktorá dáva predstavu o hladinu týchto markerov predtým, ako pľúca „spracujú“ takúto toxickú informáciu.
Oveľa presnejšie, hĺbka patologického procesu v pankrease odráža štúdium pankreatických enzýmov v lymfe hrudného lymfatického kanála (ak je odvodnený za účelom detoxikácie).
Tento prístup odhaľuje zmysel lymfatický systém pri transporte ETS z interstícia poškodených orgánov do krvi. Určité informácie môže poskytnúť štúdium proteínového spektra lymfy a jej koloidného osmotického tlaku (CHSK). U pacientov s ťažkou intoxikáciou analýza prvých vzoriek odhalí tendenciu k zvýšeniu celkového proteínu (nad 40 g / l) so zvýšením koncentrácie hrubých proteínov (IgM, sialoproteíny, haptoglobíny a iné makroglobulíny), čo naznačuje prítomnosť nielen dysproteinémie, ale aj deštruktívneho degeneratívneho procesu, ktorý spôsobuje intoxikáciu.
Kritérium závažnosti ENI pri rabdomyolýze v dôsledku drvenia mäkkých tkanív, pri syndróme predĺženého drvenia veľkých svalov alebo jeho netraumatický analóg - syndróm polohovej kompresie, reperfúzny syndróm po operáciách na hlavných cievach končatín , môže byť hladina myoglobínu v krvi. Možnosť získania informácií pomocou tohto markera v traumatologickej a chirurgickej praxi umožňuje so známym predpokladom jeho využitie pri ischemických léziách myokardu. Hoci podiel tohto ENI faktora na celkovom ETS poole pri takom patologickom jave, akým je akútny infarkt myokardu, výrazne menej ako pri klasickej rabdomyolýze.
V počiatočnom štádiu septikémie umožňuje stanovenie mikrobiálnych lipopolysacharidov pomocou LAL testu, v ktorom ako hlavné činidlo pôsobí lyzát amoebocytov suchozemského kraba Limulus Poliphemus, pomerne objektívne posúdiť úroveň mikrobiálneho faktora endogénneho intoxikácia. Rovnaký test však môže naznačovať významnú úroveň endotoxémie pri absencii jasne definovaného zamerania hnisavej infekcie, napríklad pri takzvanom "septickom syndróme", ktorý sa zisťuje na pozadí refraktérneho obehového šoku.
Nepochybne je zaujímavé študovať obsah regulačných faktorov (hormónov, biologicky aktívnych látok a mediátorov tkanivového metabolizmu a zápalových mediátorov) ako ETS. Detekcia abnormálnej hladiny hormónu štítnej žľazy alebo regulačného peptidu, napríklad vazointestinálneho peptidu alebo prostaglandínov, skutočne umožňuje posúdiť závažnosť ENI a navrhnúť spôsoby jej ďalšieho rozvoja. Dôležitá informácia na určenie taktiky liečby môže poskytnúť aj štúdia primárnych poslov imunitnej odpovede IL-1 a TNF. Tieto techniky sú však dostupné iba pre veľké domáce nemocnice a diagnostické centrá.
Spomedzi testov, ktoré odrážajú imunopatologické účinky primárneho účinku endotoxikózy, sú najčastejšie používané štúdie tkanivových antigénov, hladiny cyklujúcich imunitných komplexov (CIC) a krvného komplementu. V každom prípade zvýšenie koncentrácie CIC pri súčasnom znížení hladiny C3 zložky komplementu môže naznačovať nadbytok tvorby imunitných komplexov. Môžu sa stať tak faktorom primárneho patogénneho vplyvu, ako aj faktorom sekundárnej autoagresie a podieľať sa na tkanivových a orgánových prejavoch endotoxikózy.
Viaczložkový charakter faktorov agresie, ktoré sú základom dokonca počiatočné štádiá endotoxikóza, možnosť priamej a nepriamej potenciácie patogénnych faktorov na pozadí primárnej toxémie, individualita adaptačných reakcií organizmu konkrétneho pacienta spôsobuje ťažkosti pri priamom monitorovaní závažnosti ENI pomocou „faktora – úrovne intoxikácie“. alebo algoritmus "faktor - štádium endotoxikózy". Dôležité je aj funkčné pozadie, na ktorom sa endotoxikóza vyvíja, napríklad závažnosť dehydratácie, hypoproteinémie a anémie, stav funkčného detoxikačného systému.
| Stránka 1 | celkový počet strán: 3 |
LITERATÚRA [šou] .
- 1. Artsishevskaya R. A., Samoilova K. A. Funkčné a štrukturálne zmeny povrchu ľudských erytrocytov po ožiarení UV lúčmi rôznych vlnových dĺžok. 2. Sorpcia alciánovej modrej vonkajšími zložkami blízkej membrány // Tsitologiya.- 1983.- V. 25, č. 12.- S. 1387-1392.
- Belyakov N.A., Miroshnichenko A.G., Malakhova M.Ya., Izotova O.G. Overenie endotoxikózy u pacientov s difúznou peritonitídou // Eferentná terapia.- 1995.- V. 1, č. 2.- S. 14 -19.
- Bobrinskaya I. G., Zavyalov R. P., Tiškov E. A. Arteriovenózny rozdiel medzi osmotickými a hemostatickými parametrami ako kritérium včasnej diagnózy pľúcne komplikácie s ťažkým sprievodným úrazom // Anesteziológia a resuscitácia.- 1997.- č.4.- S. 56-60.
- Vladyka A. S., Levitsky E. R., Poddubnaya L. P., Gabrielyan N. I. Stredné molekuly a problém endogénnej intoxikácie v kritických stavoch rôznych etiológií // Anestéziológia a resuscitácia.- 1987.- č. 2.- S. 37-42.
- Gabrielyan N.I., Dmitriev A.A., Kulakov G.P. Diagnostická hodnota stanovenia molekúl média v krvnej plazme pri nefrologických ochoreniach // Klinické. lekárstvo.- 1981.- č.10.- S. 38-42.
- Galaktionov S. G., Tseitin V. M., Leonova V. I. a kol. Peptidy skupiny "stredných molekúl" // Bioorganická chémia.- 1984.- T. 10, č. 1.- S. 5-17.
- Gelfand E.B., Gologorsky V.A., Gelfand B.R. Klinické charakteristiky brušnej sepsy u chirurgických pacientov // Infekcia a antimikrobiálna terapia. - 2000. - V. 2, č. 1.- S. 6-11.
- Goncharova V. A., Zhangelova M. B., Voinov V. A. et al. Štúdium biologicky aktívnych látok v krvi pri postperfúznom pľúcnom syndróme // Anestéziológia a resuscitácia.- 1988.- č.1.- S. 17-20.
- Gryzunov Yu. A., Dobretsov G. E. Krvný sérový albumín v klinickej medicíne.- M.: Irius, 1994.- -226 s.
- Ershov A. L. Diagnostika štádií endogénnej intoxikácie v pooperačné komplikácie v brušnej chirurgii // Endogénne intoxikácie.- Petrohrad: SPbMAPO, 1994.- S. 70-71.
- Eryukhin I. A., Shashkov B. V. Endotoxikóza na chirurgickej klinike. - Petrohrad: Logos, 1995. - 304 s.
- Malakhova M. Ya. Spôsob registrácie endogénnej intoxikácie - Petrohrad: SPbMAPO, 1995. - 35 s.
- Marusanov V. G., Michajlovič V. A., Domanskaya I. A., Gulo S. L. Charakteristika štádia endogénnej intoxikácie // Eferentná terapia.- 1995.- T. I, č. 2.- S. 26-30.
- Lekárske laboratórne technológie a diagnostika: príručka. Lekárske laboratórne technológie. T. 2 / Ed. Prednášal prof. A. P. Karpiščenko. - Petrohrad: Intermedica, 1999. - 656 s.
- Masyutin V. A., Shirokov D. M., Pivovarova L. P., Nokhrin S. P. Hodnotenie laboratórnych údajov v kritických podmienkach (interpretácia, predikcia, korekcia liekov) / Ed. Prednášal prof. S. I. Peregudova.- Petrohrad: V. p., 1999.- 76 s.
- Nikolaychik V.V. Molekulárne mechanizmy rozvoj endogénnej intoxikácie a zlepšenie detoxikačných ciest: Abstrakt práce. diplomová práca .... doktor lekárskych vied. - M., 1984.- 43 s.
- Obolensky S.V., Malakhova M.Ya., Ershov A.L. Metabolický stav tela, metódy registrácie a interpretácie výsledkov // Extrémne stavy a postresuscitačná patológia. - Novosibirsk, 1989. - S. 79-86.
- Obolensky S. V., Malakhova M. Ya., Ershov A. L. Diagnostika štádií endogénnej intoxikácie a diferencované použitie metód eferentnej terapie // Vesti khirurgii.- 1991.- T. 146, č. 3.- S. 95-100.
- Rybachkov V.V., Malafeeva E.V. Povaha a mechanizmy účinku endogénnej intoxikácie // Klinika a liečba endogénnej intoxikácie pri akútnych chirurgických ochoreniach - Jaroslavľ, 1986. - S. 5-43.
- Togaibaev A. A., Kurguzkin A. V. Hemosorpcia v núdzových podmienkach.- Alma-Aga: Science of KazSSR, 1988.- S.136.
- Tulíková Z.A. Stredne molekulárne uremické toxíny: (prehľad literatúry) // Voprosy med. Chémia.- 1983.- T. 29. číslo 3. s. 108-111.
- Umansky M. A., Pinchuk L. B., Pinchuk V. G. Syndróm endogénnej intoxikácie - Kyjev: Nauk, Dumka, 1979. - 204 s.
- Fedorovič V. Yu., Ostrovskaja E.L. Spektrofotometrická expresná diagnostika pooperačných stavov infekčné komplikácie u kardiochirurgických pacientov // VI Celoruský kongres anestéziológov a resuscitátorov. - Tez. dokl.- M.: B.I., 1998.- S. 245.
- Filin V.I., Kostyuchenko A.P., Tsibin Yu.N. // Moderné predstavy o akútnej endogénnej intoxikácii // Forsírovaná diuréza na chirurgickej klinike.- L .: B.I., 1976.- S. 3-21.
- Khapevich M.D. Patogenetický a klinický význam stredne ťažkých molekúl a peroxidácie lipidov pri rozvoji syndrómu endogénnej intoxikácie pri difúznej peritonitíde: Abstrakt práce. dis. ... cukrík. med. vedy - L., 1987.- 14 s.
- Chalepko V. V., Kutushev F. X. Endogénna intoxikácia v chirurgii // Bulletin of Surgery. - 1990. - T. 144, č. 4. - S. 3-8.
- Shifrin A.G., Shifrin G.A. Vedecké základy integračnej medicíny - Záporožie: Divoké pole. 1999.- 298 s.
- Endogénna intoxikácia pri akútnych chirurgických ochoreniach / Ed. Prednášal prof. Yu.N.Belokurov a V.V. Rybachkov - 2. vyd. so zmeneným. a doplnkové .- Jaroslavľ, 2000.- 184 s.
- Endogénne intoxikácie / Tez. Inter-nar. sympóziá. - Petrohrad, 1994. - 280 s.
- Engervall P., Granstrom M., Andersson B. a kol. Monitorovanie endotoxínu, interleukínu-6 a c-reaktívneho proteínového séra u neutropenických pacientov s horúčkou // Eur. J. Haematol.- 1995.- Vol. 54, N4. - S. 226-234.
- Knaus W.A., Draper E.A., Wagner D.P. a kol. Prognostický systém APACHE-III // Chest.- 1991.- Vol.100, N6. P. 1619-1636.
- Reinke P., Docke D.W., Syrbe U. a kol. Einsatz von Blut-reinigungsverfahren bei Sepsis auf der Basis neuer Erkentnisse zur Immunopathogenese der Sepsis // Kontinuierliche Blutreinigungsverfahren in der Intensivmedizin.- Lengerich; Berlín: Pabst, 1994.- S.23-37.
- Steinmetz H.T., Herbertz A., Bertram M., Diehl V. Zvýšenie hladiny interleukínu-6 v sére pred horúčkou pri granulocytopénii a korelácia so smrťou zo sepsy // J. Infect. Dis.- 1995.- Vol.171, N1. - S.225-228.
- Topfer G., Thomae R., Zawta B. Proteín - Fragen und Antworten fur die medizinische Diagnostik.- Manncheim: Boehringer Mannheim GmbH.- 1996.- 111 S.
Zdroj: Lekárska laboratórna diagnostika programy a algoritmy. Ed. Prednášal prof. Karpishchenko A.I., Petrohrad, Intermedica, 2001
Akútna intoxikácia je ťažký patologický stav tela, ktorý je spôsobený infekčným procesom, otravou chemikáliami alebo toxínmi. Je dôležité poznať štádiá intoxikácie tela, čo táto definícia znamená, aké exogénne toxíny sú príčinou tohto stavu, aké klinické príznaky A nešpecifikované príznaky je vyjadrená, ako aj spôsoby liečby.
Všeobecná definícia akútnej otravy
Pojem "intoxikácia tela" je súhrnná a veľmi široká definícia, ktorá sa používa pri rôznych patologických stavoch a ochoreniach. Intoxikácia znamená otravu tela nejaký mikroorganizmus alebo látka. Rozlišujte medzi exogénnou a endogénnou, ako aj chronickou a akútnou intoxikáciou.
Pri akútnej otrave telo súčasne dostáva veľké množstvo jedov alebo toxínov. Tento stav je vyjadrený rýchlym zhoršením stavu človeka. Ak je pacient s látkou dlhodobo v kontakte napríklad na pracovisku, tak sa začne chronicky otráviť.
Exogénna intoxikácia tela
Pri tomto type intoxikácie sa toxická látka dostáva do tela z vonkajšieho prostredia. Táto otrava môže byť chronická aj akútna. Hlavné príčiny exogénnej intoxikácie sú nasledovné:
Príčiny endogénnej otravy
Pri tejto intoxikácii sa začnú produkovať toxické látky priamo v tele. Endotoxíny môžu byť produktmi metabolických a zápalových reakcií, hormónov a enzýmov. Za určitých okolností, napríklad keď fyzická aktivita alebo akútny zápal, akút zlyhanie obličiek, dehydratácia, látky, ktoré si telo vytvára samo, sa stávajú toxickými a nebezpečnými.
Okrem toho sa produkujú endotoxíny zhubné novotvary počas rastu a progresie rakovinových nádorov. U pacientov, ktorí trpia onkologickými ochoreniami, je celý čas subfebrilná teplota telo a hladina zápalového indikátora v krvnom teste sa prevalí.
Príznaky a klinické príznaky
Príznaky a príznaky intoxikácie budú závisieť od príčiny otravy a od spôsobu, akým sa toxín dostane do tela. Opíšme hlavné črty klinických príznakov intoxikácie, berúc do úvahy etiológiu vývoja.
Otrava jedlom
V priemere sa prvé príznaky objavia počas prvých 8 hodín po konzumácii kontaminovaného alebo pokazeného jedla. Počas otravy jedovaté huby klinický obraz sa objaví po 15-20 minútach av prípade infekcie botulizmom alebo intoxikácie konzervovanými potravinami - po 20-24 hodinách.
Hlavné príznaky otravy jedlom:
- Zvracanie a nevoľnosť sú obranné reakcie organizmu. Pomocou vracania žalúdok odstraňuje baktérie a toxíny. V masách zvratkov je vidieť hlien, žlč a zvyšky jedla.
- Celková slabosť, závraty a bolesť hlavy- hlavné príznaky intoxikácie tela.
- Nie vždy sa objaví zvýšenie telesnej teploty počas otravy jedlom. Prejav tohto príznaku naznačuje závažný priebeh ochorenia a výrazný syndróm intoxikácie.
- Hnačka. Jeho frekvencia a objem budú závisieť od stupňa intoxikácie čriev a príčiny otravy. Takže so salmonelózou sú výkaly penivé a zelené a s úplavicou - vodnaté.
- S rozvojom botulizmu u pacienta časom pribúdajú známky poškodenia CNS: zrak, koordinácia, prehĺtanie, zhoršuje sa reč, môžu sa objaviť parézy, paralýza a kŕče.
- Tachykardia je znakom ťažkej intoxikácie, dehydratácie, je zaznamenaný zrýchlený pulz.
Pitie veľkého množstva alkoholu
 Intoxikácia alkoholom sa objaví 2-3 hodiny po požití alkoholu. Pri otrave metylalkoholom sa príznaky môžu objaviť až po 24 hodinách.
Intoxikácia alkoholom sa objaví 2-3 hodiny po požití alkoholu. Pri otrave metylalkoholom sa príznaky môžu objaviť až po 24 hodinách.
Spočiatku choroba prebieha na princípe otravy jedlom. Pacient zvracia, dostane hnačku, bolí ho žalúdok. Ale potom sa môžu rozvíjať záchvaty, halucinácie, človek môže upadnúť do kómy.
Otrava alkoholom je často komplikovaná poškodením obličiek a pečene. Počas syndrómu ťažkej otravy dochádza k poruche dýchania a funkcie srdca.
Upozorňujeme, že intoxikácia metylalkoholom môže spôsobiť zhoršenie zraku. Najprv si človek všimne zníženie jasnosti a ostrosti toho, čo vidí. Počas neprítomnosti liečby začína úplná slepota a po smrteľnom výsledku.
Poškodenie zásadami a kyselinami
Charakteristickým rozdielom tejto intoxikácie je popálenie sliznice pažeráka a žalúdka spôsobené látkami, ktoré pacient vypil. Zásady a kyseliny môžu spôsobiť narušenie integrity stien krvných ciev, požierať sliznicu. Otrava zásadami a kyselinami je často sprevádzaná krvácaním v gastrointestinálnom trakte.
Klinické príznaky intoxikácie kyselinami a zásadami:
- Tachykardia.
- Pálenie a bolesť v žalúdku a pozdĺž pažeráka.
- Hypotenzia (nízky krvný tlak).
- Dýchavičnosť.
- Porušenie vedomia.
- Vracanie krvavého alebo čierneho obsahu je znakom krvácania, ktoré sa objavilo.
Keď sa do tela dostanú zásady a kyseliny, sú ovplyvnené pankreas, pečeň a obličky.
Predávkovanie liekmi
akýkoľvek liek pri jeho nesprávnom použití môže spôsobiť predávkovanie a intoxikáciu. Príznaky otravy lekárske prostriedky bude závisieť od účinnej látky. Najčastejšie sa v ďalšej polhodine po užití toxickej dávky lieku objavia prvé príznaky otravy. Môžu byť podobné infekciám toxickou potravou (prejavujú sa bolesťami brucha, hnačkou, vracaním) alebo sa prejavujú príznakmi poškodenia rôznych systémov a orgánov.
Treba poznamenať, že v pokynoch pre akékoľvek lieky opisuje príznaky, ktoré sa môžu objaviť pri predávkovaní.
Infekcie bakteriálnej alebo vírusovej povahy
 Akákoľvek infekcia, prenikajúca do tela, začína viesť k syndrómu intoxikácie. Napríklad pri intoxikácii krvi, sepse, baktérie spôsobujú zápalovú systémovú reakciu, bakteriálna infekcia je zaznamenaná v mnohých systémoch a orgánoch.
Akákoľvek infekcia, prenikajúca do tela, začína viesť k syndrómu intoxikácie. Napríklad pri intoxikácii krvi, sepse, baktérie spôsobujú zápalovú systémovú reakciu, bakteriálna infekcia je zaznamenaná v mnohých systémoch a orgánoch.
Syndróm intoxikácie pri infekciách je vyjadrený zvýšením telesnej teploty na subfebrilné alebo febrilné indikátory, bolesť hlavy, zimnica, závraty a všeobecná silná slabosť. Môžu sa vyskytnúť bolesti svalov, kĺbov, hnačka a vracanie.
Plyn pre domácnosť alebo čad
Rýchlosť nárastu symptómov počas intoxikácie plynom bude závisieť od jeho koncentrácie vo vzduchu. Čím vyššia je koncentrácia, tým rýchlejšie sa vyvíja poškodenie tela.
Počas vdychovania výparov sa proteín a hemoglobín, ktorý dodáva kyslík do všetkých buniek, začne meniť na methemoglobín, látku, ktorá nie je schopná viazať kyslík. Čo vedie k hypoxii – nedostatku kyslíka, ktorý postihuje predovšetkým obličky, srdce a mozog.
Medzi príznaky intoxikácie plynom patria:

Základné diagnostické metódy
Intoxikácia sa považuje za veľmi všeobecný pojem a na to, aby lekár určil správnu etiologickú liečbu, je potrebné určiť jej príčinu. Diagnózu stanoví špecialista po vyšetrení pacienta, vyšetrení a podrobnom odobratí anamnézy. Je dôležité, aby ste svojmu lekárovi povedali nasledujúce informácie:
- Čas prejavu prvých príznakov ochorenia.
- Kontakt s infekčnou osobou v posledných týždňoch (inkubačná doba niektorých infekcií môže byť dosť dlhá).
- Nedávne choroby.
- Dostupnosť chronické choroby(napríklad hypertenzia, cukrovka, syndróm dráždivého čreva, ischemická choroba srdca atď.).
- Čo môže vyvolať ochorenie (treba povedať lekárovi, aké potraviny ste v poslednom čase jedli a brali lieky).
Nezabúdajte, že ak máte alergiu na niektorú zložku potravy alebo lieky, určite o tom musíte povedať svojmu lekárovi.
Na stanovenie presnej diagnózy, určenie patogénu a posúdenie stavu osoby môže byť potrebné ďalšie inštrumentálne a laboratórne vyšetrenie pacienta. Ak je stav osoby ťažký, potom sa diagnóza vykoná súčasne s prvou pomocou.
Zoznam diagnostických metód, ktoré môžu byť potrebné na stanovenie diagnózy počas intoxikácie:

Intoxikácia je kolektívny pojem, ktorý odráža infekciu alebo poškodenie organizmu mikroorganizmami alebo toxínmi. Toxické látky môžu pochádzať zvonku alebo byť produkované priamo telom. Liečba je predpísaná špecialistom po stanovení diagnózy. Prečo je podrobné vyšetrenie pacienta, ktoré vám umožní zistiť príčinu vývoja intoxikácie.
V súčasnosti je jedným z najťažších problémov intenzívnej starostlivosti syndróm endogénnej intoxikácie(SEI), ktorý sprevádza značný počet patologických stavov (šok, zápal pobrušnice, pankreatitída atď.), ktoré, keď sa vyvinú, môžu viesť k smrti.
Progresia endotoxikózy v dôsledku akumulácie v krvi rôzneho pôvodu, chemickej štruktúry a biologických účinkov látok nazývaných endotoxíny. Endotoxíny prispievajú k rozvoju akútnej renálnej a hepatálnej insuficiencie, kardiovaskulárnej insuficiencie, syndrómu akútnej respiračnej tiesne, čo v konečnom dôsledku vedie k vzniku mimoriadne závažného stavu - syndrómu multiorgánovej dysfunkcie.
Endogénna intoxikácia - klinický syndróm, ktorá vzniká pri patologických stavoch rôznej etiológie, spôsobených akumuláciou v tkanivách a biologických tekutinách tela produktov narušeného metabolizmu, metabolitov, deštruktívnych bunkových a tkanivových štruktúr, zničených molekúl bielkovín, pi sprevádzaných funkčnými a morfologické lézie orgánov a systémov tela.
Existujú tri hlavné väzby, ktoré určujú závažnosť stavu pacientov a závažnosť klinické príznaky: toxémia, zhoršená mikrocirkulácia, inhibícia funkcií vlastných detoxikačných a ochranných systémov tela.
Hlavný odkaz patogenéza syndrómu endogénnej intoxikácie je toxémia. Žiaľ, jednoznačná diferenciácia toxických látok endogénneho pôvodu je prakticky nemožná. V každom konkrétnom prípade však možno rozlíšiť „primárne“ a „sekundárne“ endotoxíny. Takže s popáleninami, predĺženým syndrómom rozdrvenia, vyhladením cievne ochorenia"primárne" sú produkty degradácie bielkovín, "sekundárne" - produkty prirodzeného metabolizmu, ktorých hromadenie v tele je dôsledkom inhibície funkcií prirodzenej detoxikácie a vylučovania.
Endotoxémia, narušenie tonusu periférnych ciev, reológie krvi, kinetických a mechanických vlastností krviniek, vedie k tkanivovej hypoxii, ktorá je jedným z dôležitých článkov v patogenéze SEI, ktorej priebeh sa zhoršuje znížením funkcie prirodzené detoxikačné a vylučovacie orgány. Toxíny blokujú väzbové miesta molekúl albumínu, čo vedie k zníženiu účinnosti medikamentózna liečba pretože tento proteín je transportným činidlom pre mnohé farmakologické liečivá.
Klinika syndrómu endogénnej intoxikácie.
Porovnanie experimentálnych a klinických štúdií odhalilo nasledujúce štádiá vývoj syndrómu endogénnej intoxikácie.
I štádium syndrómu endogénnej intoxikácie. Reaktívne-toxické sa vyskytuje v reakcii na vytvorenie primárneho deštruktívneho zamerania alebo traumatického poranenia. Laboratórne príznaky tohto štádia sú zvýšenie krvných hladín stredne ťažkých molekúl (MSM), produktov peroxidácie lipidov (DC a MDA), zvýšenie LII.
II štádium syndrómu endogénnej intoxikácie- štádium ťažkej toxémie vzniká po prelomení gastohematologickej bariéry, kedy sa endotoxíny vytvorené v primárnom ohnisku intoxikácie dostávajú do cirkulujúcej krvi s následnou distribúciou a hromadením v organizme. V závislosti od stavu organizmu, jeho odolnosti a počiatočnej úrovne detoxikácie a imunitných systémov izolované kompenzované a dekompenzované štádiá ťažkej toxémie.
III štádium syndrómu endogénnej intoxikácie- pozoruje sa multiorgánová dysfunkcia (MMOD) s ďalšou progresiou patologického procesu v dôsledku ťažkého endotoxínového poškodenia rôznych orgánov a systémov s rozvojom ich funkčnej dekompenzácie!. Klinicky sa toto štádium prejavuje poruchou vedomia, hypoxiou, ťažkým srdcovým zlyhaním, oligúriou, paralytickým ileom. V krvi sa stanovuje vysoká koncentrácia kreatinínu, močoviny, bilirubínu.
Zo všeobecného hľadiska pojem "endogénna intoxikácia" (endotoxikóza) znamená patologický stav(syndróm), ktorý sa vyvíja s rôzne choroby v dôsledku akumulácie rôznych toxických látok endogénneho pôvodu v organizme pri nedostatočnej funkcii prirodzeného biologického detoxikačného systému.
Teda rozvoj endogénnej intoxikácie (toxikokinetika) a jej klinické prejavy(toxikodynamika) dodržiavajú všeobecné zákony toxického pôsobenia diskutované vyššie.
výsledky vedecký výskum uskutočnené za posledných 10-15 rokov, nám umožnilo vytvoriť koncept biochemického substrátu endogénnej intoxikácie, ktorý najčastejšie pôsobí ako množstvo látok strednej molekulovej hmotnosti. Klinicky tento syndróm prvýkrát opísal L Babb (1971) u pacientov s CRF s ťažkým neurotoxickým syndrómom. Pozostáva z produktov konečného metabolizmu, intermediárneho a zmeneného metabolizmu a hladina ich obsahu v krvi koreluje so závažnosťou stavu pacientov, závažnosťou klinických a laboratórnych prejavov intoxikácie, ako aj mortalitou.
Vo všeobecnom súbore látok s priemernou molekulovou hmotnosťou by sa mali rozlišovať predovšetkým oligopeptidy s molekulovou hmotnosťou do 10 kDa, medzi ktorými sa rozlišujú regulačné a neregulačné peptidy.
Regulačné peptidy sú hormóny, ktoré hrajú dôležitú úlohu v procese vitálnej aktivity, zabezpečujú homeosgas a patogenézu rôznych chorôb, napríklad neurotenzíny, neurokiníny, endorfíny, vazoaktívny črevný peptid, somatostatín a iné, ktoré poskytujú analýzu vplyvu vonkajšieho prostredia na tele.
Neregulačné peptidy – biologicky účinných látok toxíny (bakteriálne, popáleninové, črevné a pod.) alebo vznikajúce vo vnútri tela v dôsledku autolýzy, ischémie alebo hypoxie orgánov, intenzívnej proteolýzy produktov rôznych metabolických procesov a najrozsiahlejšiu skupinu neustále identifikovaných peptidov tvoria fragmenty kolagénu fibrinogén a iné bielkoviny krvnej plazmy vylučované močom pri rôznych ochoreniach a syndrómoch, popáleninách, obličkových a zlyhanie pečene, úrazy s kompresiou tkaniva, infekcie (najmä so sepsou), pankreatitída, onkologické a autoimunitné ochorenia atď.
Okrem toho existuje aj veľká skupina nebielkovinových stredne a nízkomolekulárnych látok – metabolitov, katabolických a anabolických, ktorých biologická aktivita je veľmi rôznorodá od účasti na homeostáze až po alteráciu pôsobenia v toxických koncentráciách. Patria sem napríklad močovina, kreatinín, cholesterol, bilirubín atď.
Samostatné zložky skupiny stredných molekúl:
- majú neurotoxické účinky
- spôsobiť sekundárnu imunosupresiu,
- majú inhibičný účinok na erytropoézu, biosyntézu proteínov a nukleotidov, tkanivové dýchanie, zvyšujú permeabilitu membrán, zvyšujú peroxidáciu lipidov,
- majú cytotoxický účinok
- narušiť sodíkovo-draslíkovú rovnováhu, mikrocirkuláciu krvi, lymfy atď.
Je zrejmé, že hlavný patologický proces endotoxikózy sa rozvíja na bunkovej a molekulárnej úrovni a je spojený so zmenou vlastností bunkových membrán, čo vedie k narušeniu intracelulárnej homeostázy.
Podľa vyššie uvedených údajov je hlavnou príčinou rozvoja syndrómu endotoxikózy v kritických stavoch akumulácia skupiny zlúčenín strednej molekulovej hmotnosti s rôznou biologickou aktivitou v dôsledku patologickej degradácie proteínov v dôsledku zvýšenej proteolýzy a iných deštruktívnych vplyvov zameraných na urgentné zásobovanie organizmu určitým súborom aminokyselín nevyhnutných v extrémnych podmienkach.podmienkach na zabezpečenie tvorby hormónov a enzýmov, regenerácie bielkovín, krvotvorby a iných fyziologických funkcií. S tvorbou týchto stredne molekulárnych zlúčenín sa vytvára akýsi "bludný kruh", v ktorom zvýšenie koncentrácie v krvi a spotreba týchto látok má za následok ich ďalšiu produkciu patologického charakteru. Hlavným cieľom terapeutických detoxikačných opatrení je preto hemokorekcia zameraná na zníženie koncentrácie biologicky najaktívnejších zlúčenín so strednou molekulovou hmotnosťou v krvi alebo ich neutralizáciu.
V klinickej toxikológii je pojem endotoxikóza dlhodobo spájaný najmä s toxickým poškodením pečene a obličiek ako dôležitých zložiek prirodzeného detoxikačného systému organizmu. Súčasne boli zistené klinické a laboratórne príznaky endotoxikózy v somatogénnom štádiu otravy hepatotoxickými a nefrotoxickými látkami 3-4 dni po nástupe ochorenia pri vzniku hepato-renálneho zlyhania. Endotoxikóza sa však rozvinie aj v toxikogénnom štádiu akútnej otravy neuro- a psychotropnými látkami krátko po chemickom poranení bez nápadného poškodenia funkcie pečene a obličiek.
Už pri prijatí do nemocnice 80% ťažkých a stredne ťažkých pacientov (kóma) vykazuje zvýšenie hladiny "stredných molekúl" v krvi o 23-83% normy. Súčasne je zaznamenané významné zvýšenie agregačnej aktivity erytrocytov, krvných doštičiek a ESR (o 40,8,80 a 65%). Súčasne sa stanovujú kritické koncentrácie vyššie uvedených toxických látok v krvi, čo naznačuje vysokú intenzitu chemického poškodenia tela a najinformatívnejšími ukazovateľmi toxicity krvi sú hladina „stredných molekúl“ v krvi a stupeň zvýšenia leukocytového indexu intoxikácie a indexu posunu neutrofilov.
Liečba endogénnej intoxikácie
Po mnoho storočí bolo hlavným smerom v liečbe otravy používanie protijedov, ktoré sa začalo na začiatku novej éry (Avicenna, cca 1000 n. l.), ktoré vo väčšine prípadov neprinieslo očakávané klinické výsledky s ďalším odborným hodnotením. z nich. praktické uplatnenie Späť v 60. rokoch XX storočia, s akumuláciou klinické skúsenosti práce prvých špecializovaných toxikologických oddelení, používanie antidot - analeptík pri otravách liekmi na spanie a drogy kvôli ich nízkej účinnosti a riziku komplikácií. Neskôr, do konca storočia, sa ukázalo, že vo všeobecnosti sa implementácia klinického účinku farmakoterapie v akútnej otravy zabrániť toxikogénnej blokáde mnohých liekových receptorov a rozvoju hypoxie, čo vedie k absencii alebo skresleniu očakávaných výsledkov. Druhým historickým smerom v liečbe toxikózy bolo využitie metód na stimuláciu prirodzenej detoxikácie organizmu vo forme takzvaných galenických prípravkov (Galen, cca 200 n. l.), ktoré sú odpradávna v každej lekárni. ako emetikum, laxatívum a diuretiká rastlinného pôvodu s názvom "Alexipharmika".
V budúcnosti, s rozvojom všeobecnej klinickej toxikológie a resuscitácie, ktorá umožňuje efektívne podporovať základné funkcie vitálnych funkcií organizmu, vrátane detoxikácie, bolo možné túto detoxikáciu výrazne stimulovať, čo na návrh akademika Yu M. Lopukhin (1989), bol nazývaný "eferentná terapia" a čoskoro sa stal hlavným prúdom v liečbe otravy.
Tretím smerom, ktorého účelom bolo zníženie koncentrácie toxických látok priamo v krvi, je prekrvenie, ktoré sa zrejme využíva už v r. Staroveký Egypt, a neskôr vyvinutá operácia čiastočnej náhrady krvi pacienta krvou darcu O. S. Glozmana (1963). Táto myšlienka našla ďalšie riešenie v podobe modelovania rôznych zariadení na mimotelové čistenie krvi, z ktorých prvými boli „umelá oblička“ (60. roky) a prístroj na hemosorpciu (70. roky).
- Berúc do úvahy vyššie uvedené tradičné smery liečby akútnej toxikózy, E. A. Lužnikov (1977) navrhol klinickú klasifikáciu moderných detoxikačných metód, ktorá je v súčasnosti široko používaná v lekárskej vede a praxi. Podľa tejto klasifikácie prvá samostatná skupina (A) zahŕňa metódy na stimuláciu prirodzených procesov detoxikácie, vylučovania, biotransformácie, transportu a viazania toxických látok.
- Druhá samostatná skupina (B) predstavuje všetky metódy umelej fyzikálnej a chemickej detoxikácie, takto pomenované v súvislosti s umelo vytvoreným mimotelovým (často hardvérovým) dodatočným kanálom na odstraňovanie toxických látok, určeným na uvoľnenie prírodný systém detox a dokonca ho dočasne nahradiť.
- Tretia samostatná skupina (C) obsahuje všetky farmakologické prípravky na špecifickú (protijedovú) terapiu otravy, ktoré z vyššie uvedeného dôvodu zaujímajú v arzenáli detoxikačných prostriedkov skromné miesto a používajú sa najmä v prednemocničnom štádiu.
Okrem aktívnych detoxikačných metód, ktoré majú charakter etiologickej liečby, a preto sú najúčinnejšie v najskoršej fáze toxikogénneho štádia otravy (toxikokinetická korekcia), pri komplikovanej forme ochorenia, keď sa jeho závažnosť zvyšuje, zohráva úlohu tzv. symptomatická terapia, zvyčajne s resuscitačným obsahom, ktorý umožňuje zachrániť určité minimum životných funkcií dôležité orgány zabezpečiť možnosť vykonania detoxikačných opatrení (toxikodynamická korekcia). Najčastejšie sú hlavnými typmi komplikácií známe patologické syndrómy - toxický šok, ARF, toxicko-hypoxická encefalopatia, kardiomyopatia a endotoxikóza.
Pri endogénnej intoxikácii sa hlavná pozornosť venuje liečbe základného ochorenia, ktoré spôsobilo rozvoj tohto syndrómu (otravy, popáleniny, hepato- a nefropatia, pankreatitída atď.), avšak metódy eferentnej detoxikačnej terapie vždy zaberajú významný miesto v komplexe. lekárske opatrenia, najmä hemosorpcia, dialýza a SZ, plazmaferéza.
V klinickej toxikológii skoré použitie eferentnej terapie prispieva k výraznému zníženiu závažnosti endogénnej intoxikácie a prevencii poškodenia viacerých orgánov.
Pri akútnej otrave sa syndróm endogénnej intoxikácie zreteľne prejavuje až v somatogénnej fáze ochorenia v dôsledku chemického popálenia tráviaceho traktu, rozvoja renálnej a hepatálnej insuficiencie a toxicko-hypoxickej encefalopatie.
V toxikogénnej fáze sa fenomény endogénnej intoxikácie spontánne zastavia pri eferentnej detoxikačnej terapii zameranej na odstránenie hlavných exotoxických látok spôsobujúcich akútnu otravu z tela.
Je dôležité vedieť!
Treba si uvedomiť, že imunitná detoxikácia je pomerne neskorá evolučná akvizícia, charakteristická len pre stavovce. Jeho schopnosť "prispôsobiť sa" v boji proti cudziemu agens, ktorý sa dostal do tela, robí z imunitnej obrany univerzálnu zbraň proti takmer všetkým možným zlúčeninám s veľkou molekulovou hmotnosťou.