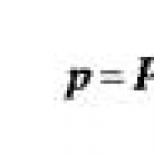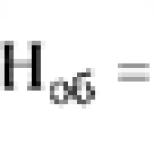Čo je qt v kardiológii. Predĺženie QT intervalu. Liečba syndrómu dlhého QT intervalu
POMOC PRE PRAXE
© Arsent'eva R.Kh., 2012 MDT 616.12-008.318
Syndróm dlhého QT intervalu
ROZA KHADYEVNA ARSENTIEVA, lekárka funkčná diagnostika Centrum psychofyziologickej diagnostiky Lekárskej a hygienickej jednotky Ministerstva vnútra Ruskej federácie v Tatarskej republike, e-mail: [e-mail chránený]
Abstraktné. Tento článok poukazuje na súčasný stav problému vrodeného a získaného syndrómu dlhého QT intervalu. Informácie o jeho prevalencii, etiológii, patogenéze, diagnostických metódach, klinike, možné spôsoby prevencia život ohrozujúcich komplikácií.
Kľúčové slová: syndróm dlhého QT intervalu.
syndróm dlhého QT intervalu
R.KH. ARSENTYEVA
abstraktné. Tento článok popisuje súčasný stav problému vrodeného a získaného syndrómu dlhého QT intervalu. Poskytol informácie o jeho prevalencii, etiológii, patogenéze, diagnostických metódach, klinickom obraze a možných spôsoboch profylaxie.
Kľúčové slová: syndróm dlhého QT intervalu.
AT posledné roky v klinickej kardiológii priťahuje problém predlžovania QT intervalu veľkú pozornosť domácich i zahraničných výskumníkov ako faktor vedúci k neočakávaná smrť. Zistilo sa, že vrodené aj získané formy predĺženia QT intervalu sú prediktormi fatálnych arytmií, ktoré následne vedú k náhlej smrti pacientov. QT interval je vzdialenosť od začiatku komplexu QRS po koniec vlny T. Z hľadiska elektrofyziológie odráža súčet procesov depolarizácie (elektrická excitácia so zmenou náboja bunky) a následných repolarizácia (obnovenie elektrického náboja) komorového myokardu.
Tento parameter sa často nazýva elektrická systola srdca (obrázok). Väčšina dôležitým faktorom, ktorý určuje trvanie QT intervalu je srdcová frekvencia. Závislosť je nelineárna a nepriamo úmerná.
História objavu LQTS siaha až do roku 1856, kedy T. Meissner opísal náhlu smrť mladého muža pri emočnom vypätí, v rodine ktorého za podobných okolností zomreli ďalšie dve deti. Len o 100 rokov neskôr, v roku 1957, A. Jervell a F. Lange-Nielsen predložili úplný klinický popis LQTS u štyroch členov tej istej rodiny, kde všetci trpeli vrodená hluchota, častou stratou vedomia a mal pretrvávajúce predĺženie QT intervalu na EKG. Čoskoro C. Romano (1963) a
O. Ward (1964) prezentoval pozorovanie podobného syndrómu, ale bez vrodenej hluchoty. LQTS s vysokou frekvenciou
sa vyskytuje u osôb s paroxyzmálnymi stavmi au detí s vrodenou hluchotou - v 0,8%. Pri vyšetrovaní pacientov s kardiogénnou synkopou bola LQTS zistená v 36 % prípadov. Bazett (1920), Fridericia (1920), Neddyn a Hogmann (1937) boli prvými, ktorí tento jav skúmali. NeddPn a Ho ^ mapp navrhli vzorec na výpočet správnej hodnoty intervalu QT: QT \u003d K / RR, kde K je koeficient
Elektrická systola srdca
0,37 pre mužov a 0,40 pre ženy. Keďže trvanie QT intervalu závisí od srdcovej frekvencie (predlžuje sa, keď sa spomalí), musí sa korigovať na srdcovú frekvenciu, aby sa vyhodnotila. Dĺžka QT intervalu je variabilná ako u jednotlivca, tak aj v populáciách. Faktory, ktoré menia jeho trvanie, sú (iba hlavné): srdcová frekvencia (HR); autonómny štát nervový systém; pôsobenie takzvaných sympatomimetík (napríklad adrenalín); rovnováha elektrolytov (najmä Ca2+); niektoré lieky; Vek; podlaha; Denná doba. Syndróm dlhého QT (LQTS) je predĺženie QT intervalu na EKG, proti ktorému sa vyskytujú záchvaty komorová tachykardia typ piruety. U detí je trvanie intervalu kratšie ako u dospelých. Existujú tabuľky, ktoré uvádzajú normy pre elektrickú systolu komôr pre dané pohlavie a frekvenciu rytmu. Ak trvanie QT intervalu u pacienta presahuje intervaly o viac ako 0,05 s, potom sa hovorí o predĺžení elektrickej systoly komôr, čo je charakteristický znak kardiosklerózy. Hlavné nebezpečenstvo spočíva v častej premene tachykardie na komorovú fibriláciu, ktorá často vedie k strate vedomia, asystólii a smrti pacienta.
Najčastejšie používané vzorce sú Bazettovo QT QT
QTc(B) = - a Frederic QTc(B) = - ,
kde QTc - korigovaná (vzhľadom na srdcovú frekvenciu) hodnota QT intervalu, relatívna hodnota; RR je vzdialenosť medzi daným komplexom QRS a predchádzajúcim, vyjadrená v sekundách.
Bazettov vzorec nie je celkom správny. Vyskytla sa tendencia k nadmernej korekcii pri vysokej srdcovej frekvencii (s tachykardiou) a k podkorekcii pri nízkej (s bradykardiou). Správne hodnoty sú v rozmedzí 300-430 pre mužov a 300-450 pre ženy. Zvýšenie rozptylu QT intervalu (AQT), čo je rozdiel medzi maximálnymi a minimálnymi hodnotami trvania QT intervalu v 12 štandardných EKG zvodoch, môže tiež slúžiť ako jeden zo spoľahlivých prediktorov SCD: AQT = QTmax - QTmin. Tento termín prvýkrát navrhli C. P. Day a kol. v roku 1990. Ak interval QT odráža trvanie celkovej elektrickej aktivity komôr, vrátane depolarizácie aj repolarizácie, potom pri absencii zmien v trvaní komorového QRS komplexu AQT odráža regionálnu heterogenitu repolarizácie. Hodnota AQT závisí od počtu zvodov EKG zahrnutých do hodnotenia, takže vylúčenie niekoľkých zvodov z analýzy môže potenciálne ovplyvniť výsledok v smere jeho poklesu. Na elimináciu tohto faktora bol navrhnutý taký indikátor ako normalizovaná disperzia QT intervalu (AQT^, vypočítaná podľa vzorca AQ^ = AQ^ - počet použitých zvodov. Normálne u zdravých jedincov v 12 zvodoch EKG tento indikátor nepresahuje 20-50 ms.
Etiológia predĺženého syndrómu
QT interval
Etiológia LQTS zostala až donedávna nejasná, hoci prítomnosť tento syndróm nemať-
koľko členov tej istej rodiny dovolilo takmer od prvého opisu považovať to za vrodená patológia. Existuje niekoľko hlavných hypotéz patogenézy LQTS. Jednou z nich je hypotéza o sympatickej nerovnováhe inervácie (pokles pravostrannej sympatickej inervácie v dôsledku slabosti alebo nedostatočnej rozvinutosti pravého hviezdicového ganglia a prevaha ľavostranných sympatických vplyvov). Zaujímavá je hypotéza patológie iónových kanálov. Je známe, že procesy depolarizácie a repolarizácie v kardiomyocytoch vznikajú v dôsledku pohybu elektrolytov do bunky z extracelulárneho priestoru a späť, riadený K + -, Na + - a Ca2 + kanálmi sarkolemy, zásobovaním energiou ktorý je uskutočňovaný Mg2+-dependentnou ATPázou. Predpokladá sa, že všetky varianty LQTS sú založené na dysfunkcii rôznych proteínov iónových kanálov. Príčiny porušenia týchto procesov, vedúce k predĺženiu QT intervalu, môžu byť zároveň vrodené a získané.Často tomu predchádza krátko-dlho-krátka (SLS) sekvencia: striedanie supraventrikulárnej extrasystoly, post -extrasystolická pauza a opakovaná komorová extrasystola. Existujú dva najviac študované patogenetické mechanizmy arytmií pri syndróme dlhého QT. Prvý mechanizmus intrakardiálnych porúch repolarizácie myokardu, a to: precitlivenosť myokardu k arytmogénnemu účinku katecholamínov. Druhým patofyziologickým mechanizmom je nerovnováha sympatickej inervácie (pokles pravostrannej sympatickej inervácie v dôsledku slabosti alebo nedostatočného rozvoja pravého hviezdicového ganglia). Tento koncept podporujú zvieracie modely (predĺženie QT intervalu po pravostrannej stelektómii) a výsledky ľavostrannej stelektómie v liečbe rezistentných foriem predĺženia QT intervalu. Podľa mechanizmu rozvoja komorových tachykardií sú všetky vrodené syndrómy LQTS klasifikované ako adrenergne závislé (komorová tachykardia sa u takýchto pacientov vyvíja na pozadí zvýšeného tonusu sympatiku), zatiaľ čo získané LQTS sú skupinou syndrómov závislých od pauzy (komorový extrasystol, hlavne pirueta, nastáva po zmene R-R intervalu vo forme SLS -sekvencií). Toto rozdelenie je skôr podmienené, pretože existujú dôkazy o prítomnosti napríklad vrodeného LQTS závislého od pauzy. Boli hlásené prípady, v ktorých medikácia viedla k manifestácii predtým asymptomatického LQTS.
Romano-Wardov syndróm môže byť výsledkom ktoréhokoľvek zo 6 typov mutácií, Jervell-Lange-Nielsenov syndróm sa vyvíja, keď dieťa dostane mutantné gény od oboch rodičov. Niektoré mutácie spôsobujú závažnejšie, iné menej ťažké formy choroby. Je dokázané, že Romano-Wardov syndróm u homozygotného variantu je závažnejší ako u heterozygotného. Podľa V.K. Gusaka et al., zo všetkých prípadov vrodeného LQTS, LQT1 predstavuje 42 %, LQT2 – 45 %, LQT3 – 8 %, LQT5 – 3 %, LQT6 – 2 %. Zistilo sa, že LQT1 je charakterizovaná rozšírenou T vlnou, LQT2 – s nízkou amplitúdou a dvoma hrbolčekmi a LQT3 – normálnou T vlnou. Najdlhšie trvanie QTc sa pozoruje pri LQT3. Zaujímavosťou je rozdiel v trvaní
trvanie QT intervalu v noci: pri LQT1 sa interval QT o niečo skráti, pri LQT2 sa mierne predĺži, pri LQT3 sa výrazne predĺži. Manifestácia klinických prejavov v LQT1 sa častejšie pozoruje vo veku 9 rokov, s LQT2 - v 12 rokoch, s LQT3 - v 16 rokoch. Špeciálny význam má intervalové meranie po fyzická aktivita. V LQT1 sa synkopa vyskytuje častejšie počas cvičenia, zatiaľ čo v LQT2 a LQT3 sa synkopa vyskytuje častejšie v pokoji. Nositelia génov LQT2 majú v 46 % prípadov tachykardiu a synkopu vyvolanú ostrými zvukmi.
vrodené formy
Vrodené formy syndrómu predĺženia QT intervalu sa stávajú jednou z príčin úmrtí u detí. Úmrtnosť pri neliečených vrodených formách tohto syndrómu dosahuje 75 %, pričom 20 % detí zomiera do roka po prvej strate vedomia a asi 50 % v prvej dekáde života. Vrodené formy syndrómu dlhého QT zahŕňajú Gervell-Lange-Nielsenov syndróm a Romano-Wardov syndróm.
Gervell-Lange-Nielsenov syndróm - zriedkavé ochorenie, má autozomálne recesívny typ dedičnosti a je kombináciou vrodeného hluchota-mutizmu s predĺžením QT intervalu na EKG, epizódami straty vedomia a často končí náhlou smrťou detí v prvej dekáde života. Romano-Wardov syndróm má autozomálne dominantný vzor dedičnosti. Má to podobné klinický obraz: srdcové arytmie, v niektorých prípadoch so stratou vedomia na pozadí predĺženého QT intervalu u detí bez poruchy sluchu a reči. Frekvencia detekcie predĺženého QT intervalu u detí školského veku s vrodeným nepočujúcim mutizmom na štandardnom EKG dosahuje 44 %, pričom takmer polovica z nich (asi 43 %) mala epizódy straty vedomia a záchvaty tachykardie. Pri 24-hodinovom monitorovaní EKG malo takmer 30 % z nich paroxyzmy supraventrikulárnej tachykardie, približne každý piaty „jogging“ komorovej tachykardie typu „pirueta“. Sada diagnostické kritériá. "Veľké" kritérium je predĺženie QT intervalu o viac ako
0,44 ms, anamnéza epizód straty vedomia a prítomnosť syndrómu dlhého QT intervalu u rodinných príslušníkov. "Malé" kritériá sú vrodená senzorineurálna strata sluchu, epizódy striedania T-vlny, pomalá srdcová frekvencia (u detí) a abnormálna ventrikulárna repolarizácia.
Najväčšiu diagnostickú hodnotu má výrazné predĺženie QT intervalu, paroxyzmy tachykardie torsade de pointes a epizódy synkopy. Vrodený syndróm dlhého QT intervalu je geneticky heterogénna porucha, ktorá zahŕňa viac
5 rôznych lokusov chromozómov. Boli identifikované najmenej 4 gény, ktoré určujú vývoj vrodeného predĺženia QT intervalu. Najčastejšou formou syndrómu dlhého QT intervalu u mladých ľudí je kombinácia tohto syndrómu s prolapsom mitrálnej chlopne. Frekvencia detekcie predĺženia QT intervalu u jedincov s prolapsom mitrálnej a / alebo trikuspidálnej chlopne dosahuje 33%.
Podľa väčšiny výskumníkov je prolaps mitrálnej chlopne jedným z prejavov vrodenej dysplázie. spojivové tkanivo. Medzi ďalšie prejavy - slabosť spojivového tkaniva, zvýšená rozťažnosť kože, astenický typ postavy, lievikovitá deformácia hrudníka, skolióza, ploché nohy, syndróm kĺbovej hypermobility, krátkozrakosť, kŕčové žilyžily, hernie. Množstvo výskumníkov identifikovalo vzťah medzi zvýšenou variabilitou OT intervalu a hĺbkou prolapsu a/alebo prítomnosťou štrukturálne zmeny(myxomatózna degenerácia) cípov mitrálnej chlopne. Jednou z hlavných príčin vzniku predĺženia intervalu WC u jedincov s prolapsom mitrálnej chlopne je geneticky vopred daný alebo získaný nedostatok horčíka.
Získané formuláre
Získané predĺženie OT intervalu sa môže vyskytnúť pri aterosklerotickej alebo poinfarktovej kardioskleróze, pri kardiomyopatii, počas a po myo- alebo perikarditíde. Zvýšenie rozptylu OT intervalu (viac ako 47 ms) môže byť tiež prediktorom rozvoja arytmogénnej synkopy u pacientov s defekty aorty srdcia.
Neexistuje konsenzus o prognostickej hodnote zvýšenia rozptylu intervalu WC u pacientov s postinfarktovou kardiosklerózou: niektorí autori odhalili u týchto pacientov jasný vzťah medzi predĺžením trvania a rozptylom intervalu WC (na EKG ) a riziko vzniku paroxyzmov ventrikulárnej tachykardie, iní výskumníci takýto vzorec nenašli. V prípadoch, keď u pacientov s postinfarktovou kardiosklerózou v pokoji nie je zvýšená hodnota rozptylu intervalu WC, treba tento parameter posúdiť počas záťažového testu. U pacientov s postinfarktovou kardiosklerózou je hodnotenie rozptylu WC na pozadí záťažových testov mnohými výskumníkmi považované za informatívnejšie pre overenie rizika ventrikulárnych arytmií.
Predĺženie OT intervalu možno pozorovať aj s sínusová bradykardia, atrioventrikulárna blokáda, chronická cerebrovaskulárna insuficiencia a nádory mozgu. Akútne prípady predĺženia OT intervalu môžu nastať aj pri úrazoch (hrudník, kraniocerebrálne).
Autonómna neuropatia tiež zvyšuje OT interval a jeho rozptyl, preto sa tieto syndrómy u pacientov vyskytujú cukrovka I a II typy. Predĺženie OT intervalu môže nastať pri nerovnováhe elektrolytov s hypokaliémiou, hypokalciémiou a hypomagneziémiou. Takéto stavy sa vyskytujú pod vplyvom mnohých dôvodov, napríklad pri dlhodobom užívaní diuretík, najmä slučkových diuretík (furosemid). Opisuje sa rozvoj komorovej tachykardie typu „pirueta“ na pozadí predĺženia intervalu WC s fatálnym koncom u žien, ktoré držali nízkobielkovinovú diétu s cieľom znížiť telesnú hmotnosť. OT interval sa môže predĺžiť použitím niekoľkých terapeutických dávok lieky najmä deriváty chinidínu, prokaínamidu a fenotiazínu. Predĺženie elektrickej systoly komôr možno pozorovať v prípade otravy liekmi a látkami, ktoré majú kardiotoxický účinok a spomaľujú
repolarizačné procesy. Napríklad pahikarpín v toxických dávkach, množstvo alkaloidov, ktoré blokujú aktívny transport iónov do bunky myokardu a majú aj ganglioblokujúci účinok. Známe sú aj prípady predĺženia OT intervalu pri otravách barbiturátmi, organofosforovými insekticídmi a ortuťou.
Je dobre známe, že predlžuje OT pri akútnej ischémii myokardu a infarkte myokardu. Pretrvávajúce (viac ako 5 dní) predĺženie OT intervalu, najmä v kombinácii so skorými komorovými extrasystolmi, je prognosticky nepriaznivé. Títo pacienti vykazovali významné (56-násobné) zvýšené riziko náhlej smrti. S rozvojom akútnej ischémie myokardu sa výrazne zvyšuje aj rozptyl intervalu WC, pričom sa zistilo, že rozptyl intervalu WC sa zvyšuje už v prvých hodinách akútneho infarktu myokardu. Neexistuje konsenzus o rozptyle intervalu WC, ktorý je jasným prediktorom náhlej smrti u pacientov s akútnym infarktom myokardu. Zistilo sa, že ak je rozptyl viac ako 125 ms pri prednom infarkte myokardu, potom ide o prognosticky nepriaznivý faktor indikujúci vysoké riziko smrteľný výsledok. U pacientov s akútnym infarktom myokardu je narušený aj cirkadiánny rytmus OT disperzie: je zvýšený v noci a ráno, čo zvyšuje riziko náhlej smrti v túto dennú dobu. V patogenéze predlžovania WC s akútny infarkt myokard nepochybne zohráva úlohu hypersympatikotónie, čím mnohí autori vysvetľujú vysokú účinnosť β-blokátorov u týchto pacientov. Okrem toho je vývoj tohto syndrómu založený na poruchách elektrolytov, najmä nedostatku horčíka.
Výsledky mnohých štúdií uvádzajú, že až 90 % pacientov s akútnym infarktom myokardu má nedostatok horčíka. Zistila sa aj inverzná korelácia medzi hladinou horčíka v krvi (sérum a erytrocyty) a intervalom WC a jeho rozptylom u pacientov s akútnym infarktom myokardu. Zaujímavé sú údaje o cirkadiánnych rytmoch rozptylu WC, získané počas monitorovania EKG Holterom. Zistilo sa výrazné zvýšenie rozptylu intervalu WC v nočných a skorých ranných hodinách, čo môže zvýšiť riziko náhlej smrti v tomto čase u pacientov s rôznymi kardiovaskulárnymi ochoreniami (ischémia a infarkt myokardu, srdcové zlyhávanie a pod.). Predpokladá sa, že zvýšenie rozptylu OT intervalu počas nočných a ranných hodín je spojené so zvýšenou aktivitou sympatiku v tomto čase dňa. Keď sa to robí, spolu s trvalým alebo prechodným predĺžením OT intervalu, pacienti môžu pociťovať bradykardiu počas dňa a relatívne zvýšenie srdcovej frekvencie v noci, zníženie cirkadiánneho indexu (CI).
Charakteristické črty sú tiež predĺženie všetkých parametrov intervalu OT; identifikácia komorových tachyarytmií alebo krátkych paroxyzmov komorovej tachykardie, ktoré sa nie vždy prejavujú synkopou; striedanie vlny T; rigidný cirkadiánny rytmus srdcovej frekvencie, často CI menej ako 1,2; identifikácia sekvencie SLS; zníženie funkcie koncentrácie rytmu (zvýšenie rMSSD); známky paroxyzmálnej pripravenosti srdcového rytmu (nárast o viac ako 50% období zvýšeného rozptylu počas spánku).
Holterovo monitorovanie EKG rôzne porušenia rytmus vedenia oveľa častejšie
sa zisťujú pri systolicko-diastolickej dysfunkcii myokardu, pričom frekvencia ich záchytu je takmer 2-krát vyššia ako záchyt arytmií u pacientov s izolovanou diastolickou dysfunkciou myokardu. To naznačuje, že porucha rytmu a QT index sú jedným z kritérií závažnosti myokardiálnej dysfunkcie. Holterovo monitorovanie EKG v kombinácii s VEM a každodennou fyzickou aktivitou umožňuje posúdiť koronárnu rezervu u pacientov s ischemickou chorobou srdca - bol zistený vzťah medzi predĺžením QT intervalu a stupňom poškodenia koronárne artérie a zníženie koronárnej rezervy. U pacientov s menšou toleranciou záťaže pri závažnejších formách ischemickej choroby srdca sa pozoruje významné predĺženie korigovaného QT intervalu, zvlášť výrazné na pozadí ischemického posunu ST segmentu, čo môže naznačovať vysoké riziko fatálnych arytmií. Podľa moderné prístupy na vyhodnotenie údajov Holterovho monitorovania EKG by trvanie QT intervalu u detí nemalo presiahnuť 400 ms nízky vek, 460 ms - u detí predškolskom veku, 480 ms - u starších detí, 500 ms - u dospelých.
V roku 1985 Schwarts navrhol súbor nasledujúcich diagnostických kritérií pre syndróm LQTS, ktoré sa dodnes používajú:
1. "Veľké" kritériá pre diagnózu LQTS: predĺženie QT intervalu (QT s viac ako 0,44 s); anamnéza synkopy; rodinní príslušníci majú LQTS.
2. "Malé" kritériá pre diagnózu LQTS: vrodená senzorineurálna hluchota; epizódy striedania vlny T; bradykardia (u detí); patologická repolarizácia komôr.
Diagnózu je možné stanoviť za prítomnosti dvoch „hlavných“ alebo jedného „hlavného“ a dvoch „malých“ kritérií. Predĺženie QT intervalu môže viesť k akútnym arytmiám a náhlej smrti u alkoholikov. Je možná aj skorá nešpecifická zmena na EKG koncovej časti komorového komplexu s negatívnou dynamikou týchto zmien vo vzorke „etanolu“ a absenciou pozitívnej dynamiky pri použití vzorky s nitroglycerínom a obzidanom. Najväčšiu diagnostickú hodnotu má meranie trvania QT intervalu po ukončení pohybovej aktivity (a nie pri jej realizácii).
Doteraz neexistuje spôsob liečby, ktorý by eliminoval riziko nežiaducich následkov u pacientov s LQTS. Existujúce prístupy k manažmentu pacientov zároveň umožňujú eliminovať alebo výrazne znížiť frekvenciu paroxyzmálnej tachykardie a synkopy a znížiť úmrtnosť viac ako 10-krát.
Medikamentóznu liečbu možno rozdeliť na núdzovú a dlhodobú. Ten je založený hlavne na použití p-blokátorov. Výber týchto liekov je založený na teórii špecifickej sympatikovej nerovnováhy, ktorá zohráva vedúcu úlohu v patogenéze ochorenia. Preventívny účinok ich užívania dosahuje 80 %. V prvom rade je potrebné eliminovať etiologické faktory ktoré viedli k predĺženiu QT intervalu tam, kde to bolo možné. Napríklad by ste mali vysadiť alebo znížiť dávku liekov
(diuretiká, barbituráty atď.), ktoré môžu predĺžiť trvanie alebo rozptyl QT intervalu. Adekvátna liečba srdcového zlyhania podľa medzinárodných smerníc a úspešná chirurgický zákrok srdcové chyby tiež povedú k normalizácii QT intervalu.
Je známe, že u pacientov s akútnym infarktom myokardu fibrinolytická liečba znižuje veľkosť a rozptyl QT intervalu (hoci nie na normálne hodnoty). Zo skupín liekov, ktoré môžu ovplyvňovať patogenézu tohto syndrómu, treba spomenúť najmä dve skupiny: β-blokátory a magnéziové prípravky.
Klinická a etiologická klasifikácia
predĺženie QT intervalu EKG
Podľa klinických prejavov: 1. So záchvatmi straty vedomia (závraty a pod.). 2. Asymptomatické.
Podľa pôvodu: I. Vrodené: 1. Gervell-Lange-Nielsenov syndróm. 2. ^Roman-Ward.
3. ^radikálny. II. Získané: spôsobené drogami.
vrodený predlžovací syndróm
QT interval
Pacienti so syndrómom Romano-Ward a Ger-vell-Lange-Nielsen vyžadujú nepretržité užívanie β-blokátorov v kombinácii s perorálnymi magnéziovými prípravkami (magnézium orotát, 2 tablety 3-krát denne). U pacientov, u ktorých farmakologická liečba zlyhala, možno odporučiť ľavostrannú stelektómiu a odstránenie 4. a 5. ganglia hrudníka. pozitívny výsledok. Existujú správy o úspešnej kombinácii liečby p-blokátormi s implantáciou umelého kardiostimulátora. U pacientov s idiopatickým prolapsom mitrálnej chlopne by sa liečba mala začať užívaním perorálnych magnéziových prípravkov (magnerot 2 tablety 3x denne po dobu najmenej 6 mesiacov), keďže nedostatok tkanivového horčíka sa považuje za jeden z hlavných patofyziologických mechanizmov vzniku oboch Syndróm predĺženia QT intervalu a „slabosť“ spojivového tkaniva. U týchto jedincov sa po liečbe magnéziovými preparátmi znormalizuje nielen QT interval, ale aj hĺbka prolapsu hrbolčekov mitrálnej chlopne, frekvencia komorových extrasystolov, závažnosť klinických prejavov (syndróm vegetatívnej dystónie, hemoragické príznaky atď.). Pri liečbe perorálnymi magnéziovými prípravkami cez
6 mesiacov, pridanie β-blokátorov nemalo plný efekt.
Syndróm získaného predĺženia
QT interval
Všetky lieky, ktoré môžu predĺžiť QT interval, by sa mali vysadiť. Nevyhnutná je úprava elektrolytov krvného séra, najmä draslíka, vápnika, horčíka. V niektorých prípadoch to stačí na normalizáciu veľkosti a rozptylu QT intervalu a na prevenciu komorových arytmií. Pri akútnom infarkte myokardu fibrinolytická liečba a p-blokátory znižujú veľkosť disperzie QT intervalu. Tieto menovania sú podľa medzinárodných odporúčaní povinné pre
všetci pacienti s akútnym infarktom myokardu, berúc do úvahy štandardné indikácie a kontraindikácie. Aj pri adekvátnom manažmente pacientov s akútnym infarktom myokardu však u značnej časti z nich veľkosť a rozptyl QT intervalu nedosahujú normálne hodnoty, preto riziko náhlej smrti zostáva. Preto sa aktívne študuje otázka účinnosti použitia magnéziových prípravkov v akútnom štádiu infarktu myokardu. Trvanie, dávkovanie a spôsoby podávania magnéziových prípravkov u týchto pacientov neboli definitívne stanovené.
Záver
Predĺženie QT intervalu je teda prediktorom fatálnych arytmií a náhlej kardiogénnej smrti u pacientov s kardiovaskulárnymi ochoreniami (vrátane akútneho infarktu myokardu), ako aj u jedincov s idiopatickými komorovými tachyarytmiami. Včasná diagnostika predĺženia QT intervalu a jeho rozptylu, aj počas Holterovho monitorovania EKG a počas záťažových testov, umožní identifikovať skupinu pacientov so zvýšeným rizikom vzniku komorových arytmií, synkopy a náhlej smrti. účinnými prostriedkami prevencia a liečba ventrikulárnych arytmií u pacientov s vrodenou a získanou formou syndrómu predĺženia QT intervalu sú p-blokátory v kombinácii s magnéziovými preparátmi.
Relevantnosť syndrómu dlhého QT intervalu je určená predovšetkým preukázanou súvislosťou so synkopou a náhlou srdcovou smrťou, ako naznačujú výsledky mnohých štúdií vrátane odporúčaní Európskej asociácie kardiológie. Povedomie o tomto syndróme medzi pediatrami, kardiológmi, neurológmi, rodinní lekári, povinné vylúčenie LQTS ako jednej z príčin synkopy prispeje k diagnostike diskutovanej patológie a vymenovaniu adekvátnej terapie, aby sa zabránilo nepriaznivému výsledku.
literatúre
1. Shilov, A.M. Diagnostika, prevencia a liečba syndrómu predĺženia QT intervalu: metóda. odporučiť. / A.M. Shilov, M.V. Mělník, I.D. Sanodze. - M., 2001. - 28 s. Shilov, A.M. Diagnostika, profilaktika a lešenie syndrómu udlineniya QT-interval: metóda. rekom. / A.M. Shilov, M.V. Mel "nik, I.D. Sanodze. - M., 2001. - 28 s.
2. Stepura, O.B. Výsledky použitia horečnatej soli kyseliny orotovej "Magnerot" pri liečbe pacientov s idiopatickým prolapsom mitrálnej chlopne / O.B. Stepura O.O. Mělník, A.B. Shekhter, L.S. Pak, A.I. Martynov // Ruské lekárske správy. - 1999. - č. 2. - S.74-76.
Stepura, O.B. Rezul "taty primeneniya magnievoi soli orotovoi kisloty "Magnerot" pri lechenii bol" nyh s idiopaticheskim prolapsom mitral "nogo klapana / O.B. Stepura O.O. Mel"nik, A.B. Shehter, L.S. Pak, A.I. Martynov // Rossiiskie medicinskie vesti. - 1999. - č. 2. - S.74-76.
3. Makarycheva O.V. Dynamika disperzie QT pri akútnom infarkte myokardu a jej prognostická hodnota / O.V. Makarycheva, E.Yu. Vasilyeva, A.E. Radzevič, A.V. Shpektor // Kardiológia. - 1998. - Číslo 7. - S. 43-46.
Makarycheva, O.V. Dinamika disperzii QT pri ostrom infarkte miokarda i ee prognosticheskoe znachenie / O.V. Makarycheva, E. Yu. Vasiľ "eva, A.E. Radzevich, A.V. Shpektor // Kardiologiya. - 1998. - č. 7. - S.43-46.
Skutočnosť, že medikamentózna antiarytmická liečba neznižuje celkovú mortalitu, ale dokonca čiastočne vedie k jej zvýšeniu, je spôsobená rizikom paradoxného nárastu arytmií – teda proarytmického účinku látok Vaughan-Williamsovej triedy I a III. .
Indikatívne výsledky štúdie CAST (Cardiac Arrhytmia Supression Trial), ktorá pri porovnaní prekvapivo zistila, že viac pacientov po infarkte zomrelo pri pôsobení IC antiarytmík Flecainid a Encainid ako pri placebe, čo potvrdzuje proarytmický potenciál látok blokujúcich sodíkový kanál .
Ale aj antiarytmiká pôsobiace cez blokádu repolarizačných draslíkových kanálov (trieda III) nesú riziko ventrikulárnych proarytmií. Pri týchto skupinách látok sa v dôsledku predlžovania reporlarizácie dostávajú do popredia skoré post-depolarizácie a torsade-de-Pointes tachykardie (TdP).
Štúdia SWORD (Survival With Oral d-Sotalol) bola ukončená, pretože d-Sotalol (čisté antiarytmikum triedy III bez ďalšej beta-blokujúcej aktivity) u pacientov so srdcovým infarktom viac prípadov nové arytmie a smrť ako pri placebe. Ani antiarytmická liečba amiodarónom u pacientov po infarkte neprináša v porovnaní s placebom benefit z hľadiska celkovej mortality a kardiálnej mortality.
Istý čas sú popísané aj nežiaduce kardiovaskulárne účinky za určitých okolností neantiarytmických účinných látok, čo čiastočne viedlo k stiahnutiu z trhu samotným výrobcom alebo nariadením vlády. V nasledujúcom texte sa budeme zaoberať týmito nepriaznivými vplyvmi vedľajšie účinky nekardiálnych látok.
QT interval
Požadovaný čas na repolarizáciu komôr možno merať na EKG ako interval QT. Predĺžená repolarizácia sa pozná podľa predĺženia QT intervalu.
Predĺženie QT intervalu môže mať na jednej strane antiarytmický účinok, na druhej strane podporuje nástup skorých postrepolarizácií a je spojené s výskytom TdP tachykardií, ktoré sa buď spontánne zastavia, alebo môžu viesť k náhlej srdcová smrť. Explicitne predĺženie QT času (alebo frekvencia korigovaného QT času (QRc) je jedným z hlavných znakov TdP tachykardií.
QT intervaly od 350 do 440 ms (muži<430 ms, женщины <450 ms) являются нормальными, потенциально вызывающими озабоченность считаются значения от 450 до 500 ms, повышенный риск аритмий возникает со значений 500 ms.
Spolu s vrodenými formami predĺženia QT intervalu (s alebo bez hluchoty) zohrávajú dôležitú klinickú úlohu získané formy. Spolu s predĺžením QT je opísané ďalšie zvýšenie disperzie QT, čo je miera heterogenity repolarizácie.
Predĺženie QT intervalu antiarytmikami
Predĺženie QT intervalu a TdP tachykardia sú typickými vedľajšími účinkami rôznych antiarytmík (tabuľka 1). Vyskytujú sa čiastočne v závislosti od dávky a vo včasnej fáze liečby.
TdP tachykardie sa pozorujú prevažne len po konverzii sínusovej frekvencie (počas relatívnej bradykardie), a nie počas flutteru predsiení. Frekvencia takýchto arytmií sa pohybuje od 1% do 8%. Coplen vykonal metaanalýzu množstva randomizovaných štúdií chinidínu na dosiahnutie cyanotického rytmu po kardioverzii predsieňového flutteru. Liečba chinidínom bola spojená s vyššou mortalitou (2,9 % vs. 0,8 % kontrolná skupina).
Niektoré látky, ako amiodarón a Bepridil, dokonca spôsobujú predĺženie QT intervalu, ale zriedkavo TdP. Amiodarón sa dokonca používa u pacientov, u ktorých sa TdP vyvinul v dôsledku iných liekov. Je to spôsobené tým, že amiodarón blokuje nielen K + kanály, ale aj Na + - a Ca ++ kanály, ako aj beta-adrenergné receptory a zároveň znižuje riziko skorých post-repolarizácií a spustených arytmií. .
|
Stôl 1. QT- predĺženie po antiarytmikách (mod. Nach Thomas et al.) |
|
|
Droga |
Mechanizmus akcie |
|
TriedaIA Chinidin, disopyramída ( Norpace, Rhythmodul), prokaínamid* |
Blokáda Na+ kanála Predĺženie repolarizácie |
|
TriedaIII N-acetylprokaínamid*, amiodarón ( Amiobeta, Amiodarex, Amiohexal, Cordarex, tachydarínatď.), bretylium*, sotalol ( Darob, Sotabeta, Sotagamma, Sotalexa d R.) |
Blokáda K+ kanála |
|
TriedaIV Bepridil*, Lidoflazín*, Prenylamin* |
Blokáda vápnikových kanálov |
|
* V Nemecku sa už nepredáva |
|
Na príklade amiodarne možno upozorniť aj na iný problém. Hovoríme o farmakokinetickom aspekte. Eliminačný polčas pre amiodarón je 15-100 dní (priemerne 30 dní), pre aktívne metabolity deetylamiodarónu priemerne 60 dní.
Keďže rovnovážny stav kumulace je nastavený po takmer 5 polčasoch, je ľahké si predstaviť, že takéto látky sú veľmi ťažko kontrolovateľné. U 27 pacientov (55,4 + 2,4 rokov), ktorí dostávali amiodarón počas 1 roka, boli počiatočné hodnoty QTc 453 + 7 ms. Medzi 9. a 12. mesiacom rýchlo dosiahli 479 + 9 ms. Monitorovanie pacienta by malo podľa potreby zahŕňať krvné hladiny a analýzu EKG.
Komisia pre prípravky nemeckej spoločnosti lekárov už pomerne skoro poukázala na nebezpečenstvo predĺženia QT intervalu antiarytmikami triedy I a III. Vo vzťahu k fixnej kombinácii Cordicinu (160 mg chinidínu plus 80 mg verapamilu) bolo tiež indikované riziko rozvoja TdP tachyarytmií a ventrikulárneho flutteru.
Predĺženie QT intervalu „nekardiálnymi“ liekmi
Spolu s antiarytmikami triedy IA a triedy III môžu k rozvoju predĺženia QT intervalu a TdP tachykardií viesť aj niektoré ďalšie farmakologické lieky, ktoré sa nepovažujú za antiarytmiká alebo „kardiaká“.
Stiahnutia z trhu
V posledných rokoch boli niektoré lieky stiahnuté z nemeckého aj amerického trhu kvôli závažným nepriaznivým kardiovaskulárnym účinkom.
Už začiatkom roku 1998 bolo v USA stiahnuté antihistaminikum Terfenadin (Teldane). V roku 1999 nasledoval Astemizol v Nemecku a USA, keď sa objavili prvé náznaky ťažkých arytmií a zástavy srdca - hlavne u pacientov s ťažkou poruchou funkcie pečene a/alebo pri užívaní inhibítorov enzýmov.
V liste „Rote-Hand“ (27. októbra 1999) Glaxo Wellcome v Nemecku a USA upozornili na stiahnutie Grepafloxacínu po tom, čo – aj keď veľmi zriedkavo – spôsobil predĺženie QT intervalu s rizikom vzniku závažných arytmií (TdP). Z nemeckého trhu bolo stiahnuté aj antipsychotikum Sertindol kvôli riziku vzniku závažných nežiaducich kardiovaskulárnych príhod (predĺženie QT intervalu závislé od dávky, náhla srdcová smrť). Sertindol sa v USA nikdy nepoužíval.
V apríli 2000 Janssen stiahol prokinetický Cisaprid z trhu po tom, čo FDA podal viac ako 340 správ o abnormálnych srdcových rytmoch, z ktorých 80 malo za následok smrť. Potom nemecké úrady zrušili aj povolenie liekov s obsahom cisapridu pre závažné vedľajšie účinky. Janssen-Cilag proti tomu protestoval.
Okrem toho boli opísané ďalšie lieky predlžujúce QT interval (tabuľka 2), ktoré majú širokú škálu klinických dôsledkov. Často sa to týkalo individuálnych pozorovaní, niekedy probandov alebo pacientov v klinických štúdiách.
|
Tabuľka 2 PredĺženieQTpo „nekardiálnych“ liekoch |
|
|
Droga |
Poznámky |
|
Antipsychotiká/neuroleptiká |
|
|
Chlórpromazín (propafenín)* |
Popis prípadu (100 mg/deň) |
|
Haloperidol (Haldol a ďalší)* |
4 mg perorálne až >100 mg i.v. (popis prípadu) |
|
Primozid (Orap)* |
Zdraví probandi (6 mg perorálne) |
|
Quetiapin (Seroquel)* |
Opis prípadu (komedifikácia s inhibítorom CYP3A4 lovastatínom |
|
Tioridazín (Melleril)* |
Zdraví probandi (59 mg perorálne) |
|
Antidepresívne lieky |
|
|
Desipramín (Pertofran, Petylyl)* |
Popis prípadu (2,5 mg/kg/d) |
|
Doxepin (Aponal, Doneurin atď.)* |
Pacienti v klinickej štúdii (169 mg/deň) |
|
Nortriptylín (Nortrilen)* |
Popis prípadu (0,51 mg/kg/d) |
|
Amitriptylín (Amineurín, Saroten atď.) |
Pacienti z klinických štúdií. (150-200 mg/deň) |
|
Fluoxetín (Fluctin, Fluxet atď.) |
Pacienti klin. Výskum. (37 mg/deň) |
|
Maprotilín (Deprilept, Ludiomil atď.) |
Popis prípadu (pacient, 69 rokov, ťažké srdcové zlyhanie) |
|
Antihistaminiká (2. generácia) |
|
|
Terfenadin (Histedin atď.)* |
Zdraví probandi, pacienti s kardiovaskulárnymi ochoreniami (120-360 mg), |
|
Cetirizin (Alerid, Zyrtec) |
Zdraví probandi (do 60 mg/d) |
|
Fexofenadín (Telfast) |
Zdraví probandi, pacienti s alergickou rinitídou (180-240 mg/d), kazuistika s pokusom o reexpozíciu |
|
Loratadin Lisino) |
Zdraví probandi (10 mg/deň v kombinácii s erytromycínom), kazuistika pokusu o samovraždu (300 mg) |
|
Mizolastín (Mizollen, zolium) |
Zdraví probandi (40 mg/d) |
|
Antihistaminiká (prvá generácia) |
|
|
Chlórfenamín (Codicaps, Contac atď.) |
|
|
Difenhydramín (Emesan a iné) |
|
|
Hydroxyzín (AN 3N, Atarax atď.) |
|
|
Prometazín (Atosil, Prothazin atď.) |
|
|
makrolid antibiotiká |
|
|
Klaritromycín (Cylinid, Klacid atď.)* |
Popis prípadu (1000 mg/deň perorálne) |
|
Pacienti (500-1000 mg i.v.) Popis prípadu (2000-4000 mg i.v.) |
|
|
Spiramycín (Rovamycín, Selectomycín)* |
Novorodenci (350 000 IE/kg/deň orálne |
|
Inhibítory gyrázy |
|
|
Levoflaxín (Tavanic)* |
Popis prípadu (500 mg/deň) |
|
Moxifloxacín (Avalox)* |
Pacienti v klinickej štúdii (400 mg/deň) |
|
Beta-2-adrenergné agonisty |
|
|
Fenoterol (Berotec, Partsisten)* |
|
|
Salbutamol (Apsomol, Sultanol atď.) |
Pacienti s miernou astmou v klinickej štúdii |
|
Terbutalín (Bricanyl, Contimit, Terbul atď.) |
Pacienti s miernou astmou v klinickej štúdii |
|
Antimalarikum |
|
|
Pacienti (1800 mg/d i.v.), zdraví probandi, pacienti s hepatitídou (10 mg/kg/i.v.) |
|
|
Halofantrin (Halfan)* |
Popis prípadu (1000 mg/d perorálne). Najmä u žien sa treba vyhýbať vysokým dávkam. |
|
Droga |
Poznámky |
|
Iné |
|
|
Pacienti v klinickej štúdii (fáza II), 0,15 mg/kg i.v./d maximálne 60 dní |
|
|
Cyklofosfamid (Endoxan a iné)* |
5 z 19 pacientov na vysokodávkovej terapii |
|
Ketokonazol (Nizoral, Terzolin)* |
Zdraví probandi (400 mg/deň perorálne) |
|
pentamidín (pentakarinát)* |
Pacienti infikovaní HIV (4 mg/kg/deň) |
|
Takrolimus (Prograf)* |
Popis prípadu (5 mg i.v. denne, 0,25 mg/hodinu i.v.) |
|
Tiaprid (Tiapridex) |
Popis prípadu (300 mg/), 76 rokov navyše mierne srdcové zlyhanie. |
|
* Údaje sa nám zdali byť obzvlášť klinicky významné |
|
Antipsychotiká
V jednej z veľmi starostlivo vykonaných porovnávacích štúdií sa zistilo, že pacienti so schizofréniou, ktorí dostávali antipsychotiká (chlórpromazín, tioridazín, levomepromazín a haloperidol) v konvenčnom dávkovaní (n=59), v porovnaní s pacientmi, ktorí nedostávali antipsychotiká (n= 5) a u zdravých jedincov (n=45) sa hodnoty QTc aj rozptyl QTc predĺžili. V tejto štúdii sa však nepozorovali komorové tachykardie, pravdepodobne kvôli absencii iných rizikových faktorov.
V nedávnom prehľade boli abnormálne predĺženia QTc (>456 ms) zaznamenané obzvlášť často u pacientov starších ako 65 rokov liečených Droperidolom alebo Tioridazínom. Tioridazín a Mesoridazin (nie sú komerčne dostupné v Nemecku) klasifikovali FDA a WHO ako obzvlášť vysoko rizikové.
Droperidol IV sa používa hlavne na neuroleptanalgéziu. Janssen-Cilag ho vyrába od roku 2001. Obzvlášť náchylní boli pacienti na psychiatrickej pohotovosti, ktorí dostávali psychotikov parenterálne a často dávali hypokaliémiu.
Naopak, predĺženia QTc vyvolané atypickými antipsychotikami Risperidón, Quetiapin alebo Olanzapin neboli významné. Negatívny vplyv nemala ani komédia s inhibítormi enzýmov ako ketokonarazol, fluvoxamín či paroxetín.
Antidepresíva
Pri rôznych tricyklických antidepresívach (Clomidin, Imipramin, Desipramin, Doxepin, Nortriptylin) boli popísané nežiaduce kardiovaskulárne príhody nielen pri ich predávkovaní, ale v niektorých prípadoch aj pri použití bežných terapeutických dávok. Po desipramíne, klomipramíne a imipramíne boli zaznamenané hlásenia o náhlej srdcovej smrti.
U 69-ročného pacienta s ťažkým srdcovým zlyhaním sa rozvinula TdP tachykardia (QTc=700 ms) počas užívania Maprotilinu (50 mg/d počas niekoľkých rokov). V tomto prípade rozhodne zohrala rozhodujúcu úlohu komorbidita. Mali by existovať jasné náznaky významu komorbidity „kardiovaskulárnych chorôb“.
Na rozdiel od toho sa zdá, že po fluoxetíne a po amitriptylíne v odporúčaných dávkach nedochádza k predĺženiu QT intervalu. Pri citaloprame tiež nebolo doteraz opísané žiadne predĺženie QT intervalu.
Antihistaminiká
V jednej z prípadových kontrolovaných štúdií boli stanovené úrovne frekvencie (95% interval spoľahlivosti) komorových arytmií na 10 000 osôb/rok, napríklad pre Astemizol 8,5 (2,8-26,5), pre Cetrizin 3,6 (0,9-14,2) pre Loratadin 1,5 (0,2-10,3) a pre Terfenadin 1,0 (0,3-3,0). Zdá sa, že ženy sú o niečo náchylnejšie ako muži, pričom pacienti starší ako 50 rokov sú jednoznačne viac postihnutí ako mladší.
Toto hodnotenie rizika prevažne nesedatívnych H1 antihistaminík 2. generácie zdieľali aj iní autori. Treba poukázať najmä na závislosť týchto stavov od dávky, keďže ide o samoliečbu antihistaminiká nebezpečenstvo je obzvlášť veľké, keďže pacienti sú „titrovaní“ až do úplného vymiznutia príznakov.
Zdá sa, že kardiotoxicitu Astemizolu zohrávajú jeho dva hlavné metabolity Desmethylastemozol a Norastemizol.
Materská látka je zodpovedná hlavne za srdcové príhody spojené s Terfenadínom. Podporuje to aj skutočnosť, že kardiotoxicitu zvyšujú inhibítory enzýmov, napríklad makrolidové antibiotiká alebo antimykotiká. U zdravých mužov a žien je možné preukázať, že hodnoty QTc môžu pozitívne korelovať s hladinami terfenadínu a loratadínu v krvi. Hladiny v krvi sa zvyšujú s pridaním antidepresíva Nefazodon. Posledne menovaný je inhibítorom cytochrómu P-450-3A (CYP3A).
V súčasnosti je však nedostatočná kardiotoxicita fexofenadínu, metabolitu tefenadínu, spochybňovaná. U 67-ročného muža bola hodnota QTc po expozícii a opätovnej expozícii fexofenadínu (180 mg/d) 532 ms. - 512 ms. Základné hodnoty sa však mierne predĺžili (482-494 ms).
Okrem toho sú pozoruhodné údaje na zvieratách a izolované klinické pozorovania, že aj klasické sedatívne antihistaminiká a predovšetkým difenhydramín a vo vysokých dávkach dokonca aj hydrozysín môžu vyvolať predĺženie QT intervalu a abnormálnu ventrikulárnu repolarizáciu. Arytmogénne vlastnosti sú opísané aj pre prometazín, feniramin a chlórfenamín. Je možné, že pri zvýšená pozornosť takéto incidenty by mohli byť častejšie identifikované a klasifikované.
makrolidové antibiotiká
V rokoch 1970 až 1996 bolo FDA hlásených 346 prípadov srdcových arytmií súvisiacich s erytromycínom (58 % žien, 32 % mužov, 10 % chýbajúcich údajov). 49 pacientov hlásilo život ohrozujúce arytmie (komorové tachykardie, TdP, ventrikulárny flutter) a úmrtia (33). Rizikovými faktormi boli predovšetkým vysoké dávky a intravenózne podanie.
Erytromycín predĺžil trvanie akčného potenciálu v závislosti od dávky a znížil maximálny nárast akčného potenciálu v Purkyňových vláknach. Tieto elektrofyziologické účinky sú veľmi podobné účinkom chinidínu.
Pri klaritromycíne už v roku 1998 došlo k dvom incidentom s predĺžením QT intervalu a TdP. U zdravých probandov bolo predĺženie QT intervalu signifikantné len v kombinácii s Cisaprid prokineticum.
V pokuse na zvieratách na potkanoch sa ukázalo, že roxitromycín a azitromycín zjavne menej pravdepodobne vyvolávajú arytmie ako erytromycín alebo klaritromycín. Z tohto dôvodu by sa mala uprednostňovať liečba roxitromycínom.
Inhibítory gyrázy
Z nových fluorochinolónov bol z dôvodu vývoja TdP stiahnutý z trhu Grepafloxacin Glaxo Wellcome. Existujú aj zodpovedajúce hlásenia pre sparfloxacín a moxifloxacín. Zagam už nebol uvedený v "Roten Liste 2002".
Aj pokiaľ ide o Moxifloxacín (Avalox), výrobca jasne uvádza obmedzenia použitia a kontraindikácie; dávky 400 mg/deň sa nemajú prekročiť. Komediácia s inými proarytmickými liekmi by nemala prebiehať. Neodporúča sa používať u pacientov s poruchami elektrolytov a/alebo bradykardiou.
Existujú samostatné popisy srdcových arytmií s použitím Ofloxacínu, Levofloxacínu a Enoxacínu. Povolenie používať Clinafloxicin z dôvodu závažného vedľajšie účinky, okrem iného na predlžovanie QT, stiahli samotní výrobcovia Gödecke (alebo Parke-Davis).
Agonisty beta-2 adrenoreceptorov
Epidémia úmrtí na astmu v Japonsku bola hlásená v 60. rokoch minulého storočia v súvislosti s Isoprenalin forte. O 10 rokov neskôr bol rovnaký jav zaznamenaný s Fenoterolom (200 mg na aerosól) na Novom Zélande, v Sasktchewane (Kanada) a Japonsku. Mechanizmy tohto spojenia nie sú dobre známe. Nemožno však vylúčiť kardiovaskulárne účinky.
Fenoterol, salbutamol a terbutalín sa porovnávali s placebom u 8 pacientov s astmou v dvojito zaslepenej skríženej štúdii. Pri použití Fenoteroly sa zistilo výrazné predĺženie QT hodnôt závislé od dávky. O niečo menšie, ale zreteľné, bolo predĺženie QTc pri najvyšších dávkach salbutamolu a terbutalínu. Takmer v rovnakých pomeroch došlo k poklesu obsahu draslíka v plazme.
Pri obmedzenom používaní inhalačných beta-agonistov by sa takéto problémy dali v budúcnosti vyriešiť. Postoj zdravotníkov k tomuto fenoménu v r rozdielne krajiny rôzne. Fenoterol nie je povolený v USA.
halofantín
21 zdravých probandov dostávalo 500 mg halofantínu denne počas 42 dní a boli sledovaní ďalších 138 dní. Priemerný polčas bol 7 + 5 dní. Bolo možné preukázať jasnú závislosť od koncentrácie predĺženia QTc intervalov.
Cyklofosfamid, ketokonazol
Vysoké dávky(1400 mg/m2 počas 4 dní) Cyklofosfamid spôsobil u niektorých pacientov predĺženie hodnôt disperzie QT (43,2-83,2 ms); zatiaľ čo vtedy tam bolo akútna nedostatočnosťľavé srdce. Je možné, že tieto príhody sa vyskytujú najmä vtedy, keď sú relevantné ďalšie srdcové lézie súvisiace s antracyklínmi.
Taktiež ketokonazol (200 mg 12 hodín počas 5 dní), antimykotikum, spôsobil malé, ale významné predĺženia QTc hodnôt u zdravých probandov.
Vazodilatátory
Tiež predtým používané ako vazodilatátory, teraz vylúčené z predaja v Nemecku, látky ako Lidoflazin, Prenylamin, Bepridil majú inherentný účinok triedy 1A v závislosti od dávky, ktorý bol obzvlášť klinicky dôležitý u starších pacientov a mohol spôsobiť TdP tachykardiu.
Antagonisty serotonínu
Počas liečby antagonistami serotonínu Ketanserin a Zimedin boli tiež opísané výrazné predĺženia QT času a TdP tachykardia; a takmer vždy v prítomnosti ďalších priaznivých faktorov (hypokaliémia, bradykardia). Obe látky sa v Nemecku nepredávajú. Zimedin bol opustený na celom svete v roku 1983.
Rizikové faktory pre predĺženie QT intervalu a TdP
Sexuálna závislosť
Zvyčajne sú ženy pod viac vysoké riziko predĺženie QT a TdP ako u mužov (tabuľka 3).
|
Tabuľka 3 |
|
|
Sexuálna závislosť Ženy majú väčšie riziko Zmeny QT a výskyt Torsades-de-Pointes jasne závisia od menštruačného cyklu |
|
|
Vrodené formy* Syndróm Romana Warda Jervell-Lange-Nielsenov syndróm (s hluchotou vnútorného ucha) |
|
|
Získané formuláre |
|
|
Poruchy elektrolytov |
Hypokaliémia, hypomagneziémia, hypokalciémia |
|
Metabolické poruchy |
Hypotyreóza, hyperparatyreóza, hyperaldosteronizmus, feochromocytóm, diabetes (autonómna neuropatia) |
|
Poruchy CNS |
Intrakraniálne, subarachnoidálne krvácanie, akútna sínusová trombóza, encefalitída, poranenia hlavy |
|
Poruchy srdca |
Myokarditída, srdcový nádor, AV blokáda vysokého stupňa, dysfunkcia sínusového uzla, klinicky významná bradykardia (<50 el|vby/) |
|
Poruchy príjmu potravy |
Pôst, „tekutá bielkovinová“ diéta |
|
* Ochorenia iónových kanálov so srdcovými arytmiami |
|
Z 346 arytmií súvisiacich s erytromycínom bolo 58 % žien a 32 % mužov (údaje neboli dostupné u 10 %). Tento účinok bol potvrdený v izolovaných srdciach králikov perfundovaných erytromycínom.
Tento účinok bol teraz opäť opísaný pre Chinidin. Medzi zúčastnenými probandmi v každom prípade ženy už mali vyššie východiskové hodnoty QTc (407 = 7 ms) ako muži (395 + 9 ms), predĺženia vyvolané chinidínom boli 42 + 3 ms až 29 + 3 ms.
Pomocou experimentálne navodeného (antiarytmického Ibutilidu 0,003 mg/kg i.v. 10 min.) predĺženia QT intervalu u žien bolo možné preukázať, že najväčšie zmeny boli zistené počas prvej polovice menštruačného cyklu (fáza zrenia folikulov / proliferačná fáza).
Náhla smrť v detstve
Existujú náznaky, že predĺženie QT intervalu u novorodencov vo veku 1 týždeň bolo jednoznačne spojené so „syndrómom náhleho úmrtia dojčiat“. Rutinné EKG vyšetrenie novorodencov sa však zatiaľ neodporúča.
Zmeny elektrolytov
Poruchy elektrolytov, či už spôsobené liekmi (napr. diuretiká), alebo vo forme komorbidít, ako sú metabolické poruchy, ochorenia CNS, srdcové ochorenia a poruchy výživy, môžu podporiť nástup TdP tachykardií. Nedávno bolo u 12-ročného dievčaťa opísané predĺženie QTc intervalu v dôsledku hypokalcémie vyvolanej pseudohypoparatyreoidizmom.
Je potrebné pripomenúť, že hypokaliémiu môžu spôsobiť diuretiká (Tiazid, Furosemid), Amfotericín B i.v., kortikosteroidy a zneužívanie Laxanzienu. Hypomagneziémia známa ako „faktor mäkkej vody“. Príčiny môžu byť rôzne, napríklad geografické oblasti „mäkkej vody“, rastlinná strava chudobná na fosfáty, moderné spôsoby varenia, nápoje obsahujúce fosfáty, ako je cola, nadmerné potenie (šport, sauna), choroby a mnohé lieky.
Bradykardia
Bradykardie podporujúce nástup skorých postdepolarizácií môžu byť spôsobené okrem iného srdcovými glykozidmi alebo blokátormi beta-receptorov. TdP tachykardie boli opísané aj pri antiarytmicky zosilnených bradykardiách (sínusové bradykardie alebo AV blokáda) a po ablácii zväzku u pacientov s predoperačným tachykardickým supravodivým flutterom predsiení.
Predávkovanie liekmi
Pretože toxické vedľajšie účinky sa vyskytujú v závislosti od dávky, predávkovanie liekom je vždy spojené s určitým rizikom. Dôvody sú rôzne: úplne nedbanlivé chybné predávkovanie lekárom alebo pacientom, predávkovanie liekmi v dôsledku podhodnotenia pri dávkovaní obmedzenej funkcie obličiek, pečene a/alebo štítnej žľazy. V starobe zohráva osobitnú úlohu často znížený distribučný objem.
Môže byť tiež dôležité, že pre mnohé látky existujú pomalé a rýchle metabolizátory. Najviac ohrození sú pomalí metabolizéri. Čo sa týka izoenzýmu Cytochróm-P-450 medzi ľuďmi kaukazskej rasy, existuje 5-8% pomalých exkretorov.
Liekové interakcie
Začiatkom 90. rokov sa ukázalo, že lieky s obsahom terfenadínu sú kontraindikované nielen u pacientov s ťažkým poškodením funkcie pečene, ale aj súbežné užívanie iných liekov, ako je ketokonazol alebo makrolidové antibiotiká erytromycín, josamycín, troleandomycín, ktoré môžu súvisieť s vysoko rizikové život ohrozujúce ventrikulárne arytmie. Následne boli opäť popísané relevantné nálezy, napríklad predĺženie QTc intervalu u zdravých probandov bolo pri kombinácii Cisapridu s klaritromycínom výrazne intenzívnejšie ako pri použití každej látky samostatne.
Enzýmové inhibítory zahŕňajú rôzne makrolidové antibiotiká, najmä erytromycín, klaritromycín a troleandomycín (a naopak, nie Rqxitromycín, Rulid), chloramfenikol, ciprofloxacín, Azol-Antmycotica, napr. antagonista H2 receptora (ale nie famotidín) a inhibítor HMG-CoA reduktázy lovastatín, ktorý inhibuje izoenzým CYP3A4; tu by pravastatín mohol byť alternatívou.
Čoraz zaujímavejšia je skutočnosť, že grapefruitová šťava inhibuje metabolizmus mnohých látok metabolizovaných prostredníctvom CYP3A4, ako sú antagonisty dihydropyridínu a vápnika, Cyc-losporín, Midazolam, Triazolam, Terfenadin a Amiodaron. Môže to tiež viesť ku komplikáciám.
Záver
Ak sa u pacientov počas prebiehajúcej liečby rozvinie TdP, všetky podozrivé lieky sa majú vysadiť a majú sa upraviť akékoľvek abnormality elektrolytov. Ak neexistujú žiadne alternatívne lieky, ale je potrebné vykonať veľmi starostlivý individuálny výber dávky, berúc do úvahy komorbiditu a komédiu pacientov. Príslušný incident musí byť nahlásený farmakologickému výboru Nemeckej spoločnosti lekárov alebo farmaceutickému priemyslu.
Boli identifikované gény zodpovedné za rozvoj ochorenia, bola študovaná funkcia kardiomyocytov na molekulárnej úrovni a klinické prejavy. Dešifrovanie mutácií v génoch kódujúcich proteínové štruktúrne prvky niektorých iónových kanálov umožnilo stanoviť jasný vzťah medzi genotypom a fenotypom.
Patofyziológia
Syndróm dlhého OT intervalu vzniká v dôsledku predĺženia obdobia repolarizácie komorových kardiomyocytov, čo sa prejavuje predĺžením intervalu OT na EKG, predisponuje k výskytu komorových arytmií vo forme tachykardie piruetového typu, fibrilácie komôr. , náhla srdcová smrť. Akčný potenciál kardiomyocytu je generovaný koordinovanou prácou najmenej 10 iónových kanálov (vykonávajúcich hlavne transport iónov sodíka, vápnika a draslíka cez bunkovú membránu). Funkčné poruchy ktoréhokoľvek z týchto mechanizmov (získaných alebo geneticky podmienených), vedúce k zvýšeniu depolarizačných prúdov alebo oslabeniu procesu repolarizácie, môžu spôsobiť rozvoj syndrómu.
Vrodená forma syndrómu
Dve dedičné formy tejto patológie sú dobre študované. Najbežnejší je Romano-Wardov syndróm (autozomálne dominantná porucha s rôznou penetráciou, ktorá nemá žiadne iné fenotypové znaky) a menej častý Jervell-Lange-Nielsenov syndróm, autozomálne recesívne ochorenie, ktoré je spojené s hluchotou. Moderná klasifikácia génov teraz nahradila tieto eponymá. Identifikovalo sa šesť chromozomálnych lokusov (LQTS1-6), ktoré kódujú šesť génov zodpovedných za výskyt patológie. Každý z genetických syndrómov má aj charakteristické klinické prejavy.
Existuje spojenie medzi vrodenou a získanou formou. Nositelia genetickej abnormality nemusia vykazovať charakteristické elektrokardiografické znaky, ale pri užívaní liekov, ktoré predlžujú QT interval, ako je erytromycín, sa u takýchto ľudí môže vyvinúť torsades de pointes a spôsobiť náhlu smrť.
Získaná forma syndrómu
Klinické prejavy
Charakteristickým znakom syndrómu predĺženia OT intervalu sú opakované mdloby, vyvolané emocionálnym alebo fyzickým stresom. Zároveň sa pozoruje arytmia piruetového typu, ktorej často predchádzajú srdcové cykly „krátke-dlhé-krátke“. Takéto javy súvisiace s bradykardiou sú bežnejšie v získanej forme ochorenia. Klinické príznaky vrodenej formy sú spôsobené individuálnymi genetickými mutáciami. Žiaľ, prvým klinickým prejavom ochorenia môže byť náhla srdcová smrť.
EKG. Trvanie opraveného intervalu OT je viac ako 460 ms a môže dosiahnuť 600 ms. Podľa povahy zmien vo vlne T možno určiť špecifickú génovú mutáciu. Normálny interval WC v prítomnosti ochorenia u rodinných príslušníkov nevylučuje možnosť prenosu. Stupeň predĺženia intervalu OT je rôzny, preto je u týchto pacientov zvýšený aj rozptyl intervalu OT.
Normálne korigované QT - EXL/(RR interval) = 0,38-0,46 s (9-11 malých štvorcov).
Syndróm dlhého QT: liečba
Zvyčajne epizódy arytmie, ako je "pirueta", sú krátkodobé a zmiznú samy. Dlhodobé epizódy, ktoré spôsobujú hemodynamické poruchy, by sa mali okamžite eliminovať pomocou kardioverzie. Pri opakovaných záchvatoch alebo po zástave srdca sa intravenózne podáva roztok síranu horečnatého a následne sa kvapká a následne sa v prípade potreby vykoná dočasná stimulácia (frekvencia 90-110). Ako prípravná liečba sa pred stimuláciou začína infúzia izoprenalínu.
Získaná forma
Je potrebné identifikovať a odstrániť príčiny vývoja syndrómu. Je potrebné vysadiť lieky, ktoré spôsobujú predĺženie OT. Pred prijatím výsledkov krvných testov je potrebné podať síran horečnatý. Je potrebné rýchlo určiť hladinu draslíka v krvnom sére, zloženie plynu v krvi. Pri poklese hladiny draslíka pod 4 mmol/l je potrebná korekcia jeho hladiny na hornú hranicu normy. Dlhodobá liečba sa zvyčajne nevyžaduje, ale ak je príčinou patologického stavu ireverzibilná blokáda srdca, je potrebný trvalý kardiostimulátor.
vrodená forma
Väčšina epizód je vyvolaná prudkým zvýšením aktivity sympatického nervového systému, takže liečba by mala byť zameraná na prevenciu takýchto situácií. Najvýhodnejšími liekmi sú β-blokátory. Propranolol znižuje mieru relapsu u symptomatických pacientov. Pri absencii účinku alebo neznášanlivosti β-blokátorov je alternatívou chirurgická denervácia srdca.
Stimulácia srdca znižuje symptómy pri bradykardii vyvolanej užívaním β-blokátorov, ako aj v situáciách, keď pauzy v práci srdca vyvolávajú klinické prejavy (LOT3). Pri vrodenej forme sa kardiostimulátory nikdy nepovažujú za monoterapiu. O implantácii defibrilátora by sa malo uvažovať len vtedy, ak existuje vysoké riziko náhlej srdcovej smrti alebo ak prvým prejavom ochorenia bola náhla srdcová smrť s následnou úspešnou resuscitáciou. Inštalácia defibrilátora zabráni náhlej srdcovej smrti, ale nezabráni opätovnému výskytu torsades de pointes. Opakujúce sa šoky pre krátke epizódy môžu
výrazne znižujú kvalitu života pacientov. Starostlivý výber pacientov, súčasné vymenovanie β-blokátorov, výber režimu prevádzky defibrilátorov pomáhajú dosiahnuť úspech pri liečbe takýchto pacientov.
Asymptomatickí pacienti
Skríning medzi rodinnými príslušníkmi pacienta vám umožňuje identifikovať jednotlivcov so syndrómom dlhého QT intervalu, ktorí nikdy nemali klinické príznaky. Väčšina pacientov nezomrie na syndróm dlhého QT intervalu, ale je ohrozená smrťou (celoživotné riziko je 13 %, ak sa nelieči). V každom prípade je potrebné zhodnotiť pomer účinnosti celoživotnej liečby s možným rozvojom nežiaducich účinkov a rizikom náhlej srdcovej smrti.
Určenie rizika vzniku náhlej smrti je náročná úloha, ale s presnou znalosťou podstaty genetickej anomálie je to jednoduchšie. Nedávne štúdie ukázali potrebu začať liečbu v LOT1 s predĺžením korigovaného OT intervalu o viac ako 500 ms (u mužov aj žien); s LQT2 - u všetkých mužov a žien s predĺžením intervalu QT o viac ako 500 ms; pri LQT3 - u všetkých pacientov. V každom prípade je potrebný individuálny prístup.
- geneticky heterogénny dedičný stav charakterizovaný porušením štruktúry a funkčnosti niektorých iónových kanálov kardiomyocytov. Závažnosť prejavov patológie sa líši vo veľmi širokom rozmedzí - od prakticky asymptomatického priebehu (zisťujú sa iba elektrokardiologické príznaky) až po ťažkú hluchotu, mdloby a arytmie. Definícia syndrómu dlhého QT je založená na údajoch z elektrokardiologických štúdií a molekulárno-genetických analýz. Liečba závisí od formy patológie a môže zahŕňať nepretržitý alebo kurzový príjem beta-blokátorov, prípravkov horčíka a draslíka, ako aj inštaláciu defibrilátora-kardiovertra.

Všeobecné informácie
Syndróm dlhého QT intervalu je skupina srdcových porúch genetického charakteru, pri ktorých je narušený prechod iónových prúdov v kardiomyocytoch, čo môže viesť k arytmiám, mdlobám a náhlej srdcovej smrti. Prvýkrát takýto stav identifikovali v roku 1957 nórski lekári A. Jervell a F. Lange-Nielsen, ktorí opísali kombináciu vrodenej hluchoty, synkopálnych záchvatov a predĺženia QT intervalu u pacienta. O niečo neskôr, v rokoch 1962-64, boli podobné príznaky zistené u pacientov s normálnym sluchom – takéto prípady nezávisle od seba opísali C. Romano a O. Ward.
Toto, ako aj ďalšie objavy určili rozdelenie syndrómu dlhého QT intervalu na dva klinické varianty – Romano-Ward a Jervell-Lange-Nielsen. Prvý sa dedí autozomálne dominantným mechanizmom, jeho frekvencia v populácii je 1 prípad na 5 000 obyvateľov. Výskyt syndrómu dlhého QT intervalu Jervell-Lange-Nielsenovho typu sa pohybuje v rozmedzí 1-6:1 000 000, charakterizuje ho autozomálne dominantná dedičnosť a výraznejšie prejavy. Podľa niektorých správ sú všetky formy syndrómu dlhého QT intervalu zodpovedné za tretinu prípadov náhlej srdcovej smrti a asi 20 % náhlej smrti dojčiat.

Príčiny a klasifikácia
V súčasnosti bolo identifikovaných 12 génov, ktorých mutácie vedú k rozvoju syndrómu dlhého QT intervalu, pričom všetky kódujú určité proteíny, ktoré sú súčasťou iónových kanálov kardiomyocytov zodpovedných za prúd sodíkových alebo draselných iónov. Podarilo sa nájsť aj dôvody rozdielov v klinickom priebehu tohto ochorenia. Autozomálne dominantný Romano-Wardov syndróm je spôsobený mutáciou len jedného génu, a preto môže byť asymptomatický alebo aspoň bez straty sluchu. Pri Jervell-Lange-Nielsenovom type je defekt v dvoch génoch – tento variant okrem kardiálnych symptómov vždy sprevádza obojstranná senzorineurálna hluchota. K dnešnému dňu mutácie, o ktorých je známe, že gény spôsobujú vývoj syndrómu dlhého QT:
- Syndróm dlhého QT typu 1 (LQT1) v dôsledku mutácie génu KCNQ1 lokalizovaného na 11. chromozóme. Defekty tohto génu sa najčastejšie zisťujú v prítomnosti tohto ochorenia. Kóduje sekvenciu alfa podjednotky jednej z odrôd draslíkových kanálov v kardiomyocytoch (lKs)
- Syndróm dlhého QT typu 2 (LQT2) je spôsobená defektmi v géne KCNH2, ktorý sa nachádza na 7. chromozóme a kóduje sekvenciu aminokyselín proteínu – alfa podjednotky iného typu draslíkových kanálov (lKr).
- Syndróm dlhého QT typu 3 (LQT3) v dôsledku mutácie génu SCN5A lokalizovaného na 3. chromozóme. Na rozdiel od predchádzajúcich variantov patológie to narúša prácu sodíkových kanálov kardiomyocytov, pretože tento gén kóduje sekvenciu alfa podjednotky sodíkového kanála (lNa).
- Syndróm dlhého QT typu 4 (LQT4)- pomerne zriedkavý variant stavu spôsobeného mutáciou génu ANK2, ktorý sa nachádza na 4. chromozóme. Produktom jeho expresie je proteín ankyrín B, ktorý sa v ľudskom organizme podieľa na stabilizácii štruktúry myocytových mikrotubulov, uvoľňuje sa aj v neurogliách a bunkách sietnice.
- Syndróm dlhého QT typu 5 (LQT5)- druh ochorenia, ktorý je spôsobený defektom génu KCNE1, lokalizovaným na 21. chromozóme. Kóduje jeden z proteínov iónových kanálov, beta podjednotku draslíkových kanálov typu IKs.
- Syndróm dlhého QT typu 6 (LQT6) spôsobené mutáciou génu KCNE2, ktorý sa tiež nachádza na 21. chromozóme. Jeho expresným produktom je beta podjednotka draslíkových kanálov typu lKr.
- Syndróm dlhého QT, typ 7(LQT7, iný názov - Andersenov syndróm, na počesť detského lekára E. D. Andersena, ktorý toto ochorenie opísal v 70. rokoch) je spôsobený defektom génu KCNJ2, ktorý je lokalizovaný na 17. chromozóme. Rovnako ako v prípade predchádzajúcich variantov patológie tento gén kóduje jeden z proteínových reťazcov draslíkových kanálov.
- Syndróm dlhého QT typu 8(LQT8, iný názov je Timothyho syndróm, na počesť K. Timothyho, ktorý toto ochorenie opísal) je spôsobený mutáciou génu CACNA1C, ktorý sa nachádza na 12. chromozóme. Tento gén kóduje alfa-1 podjednotku vápnikového kanála typu L.
- Syndróm dlhého QT typu 9 (LQT9) v dôsledku defektu génu CAV3 lokalizovaného na 3. chromozóme. Produktom jeho expresie je proteín kaveolín 3, ktorý sa podieľa na tvorbe mnohých štruktúr na povrchu kardiomyocytov.
- Syndróm dlhého QT typu 10 (LQT10)- príčina tohto typu ochorenia spočíva v mutácii génu SCN4B, ktorý sa nachádza na 11. chromozóme a je zodpovedný za sekvenciu aminokyselín beta podjednotky sodíkových kanálov.
- Syndróm dlhého QT typu 11 (LQT11) spôsobené defektmi v géne AKAP9 lokalizovanom na 7. chromozóme. Kóduje špecifický proteín – A-kinázu centrozómov a Golgiho komplex. Funkcie tohto proteínu ešte nie sú dobre pochopené.
- Syndróm dlhého QT typu 12 (LQT12) v dôsledku mutácie génu SNTA1 lokalizovaného na 20. chromozóme. Kóduje alfa-1 podjednotku syntrofínového proteínu, ktorý sa podieľa na regulácii aktivity sodíkových kanálov v kardiomyocytoch.
Napriek širokej genetickej rozmanitosti syndrómu dlhého QT intervalu sú všeobecné súvislosti jeho patogenézy vo všeobecnosti rovnaké pre každú z foriem. Toto ochorenie patrí do skupiny kanálopatií, pretože je spôsobené poruchami v štruktúre určitých iónových kanálov. V dôsledku toho sa procesy repolarizácie myokardu vyskytujú nerovnomerne a nie súčasne v rôznych častiach komôr, čo spôsobuje predĺženie QT intervalu. Okrem toho sa výrazne zvyšuje citlivosť myokardu na vplyvy sympatického nervového systému, čo spôsobuje časté tachyarytmie, ktoré môžu viesť až k život ohrozujúcej komorovej fibrilácii. Zároveň rôzne genetické typy syndrómu dlhého QT intervalu majú rôznu citlivosť na určité vplyvy. Napríklad pre LQT1 sú pri záťaži charakteristické synkopálne záchvaty a arytmia, pri LQT2 sú podobné prejavy pozorované pri hlasných a ostrých zvukoch, pri LQT3 naopak rozvoj arytmií a fibrilácií v pokojnom stave (napríklad v spánku ) je charakteristickejšia.
Príznaky dlhého QT
Prejavy syndrómu dlhého QT sú dosť rôznorodé. Pri závažnejšom klinickom type Jervell-Lange-Nielsenovej majú pacienti hluchotu, časté mdloby, závraty a slabosť. Navyše v niektorých prípadoch sú v tomto stave zaznamenané epileptoidné kŕčové záchvaty, čo často vedie k nesprávnej diagnóze a liečbe. Podľa niektorých genetikov 10 až 25 % pacientov so syndrómom dlhého QT intervalu dostáva nesprávnu liečbu a rozvinie sa u nich náhla srdcová alebo detská smrť. Výskyt tachyarytmií a synkop závisí od vonkajších vplyvov – napríklad pri LQT1 k tomu môže dôjsť na pozadí fyzickej aktivity, pri LQT2 k strate vedomia a fibrilácii komôr z ostrých a hlasných zvukov.
Miernejšia forma syndrómu dlhého QT intervalu (typ Romano-Ward) je charakterizovaná prechodnou synkopou (synkopou) a zriedkavými záchvatmi tachyarytmie, ale nedochádza k strate sluchu. V niektorých prípadoch sa táto forma ochorenia s výnimkou elektrokardiografických údajov nijako neprejavuje a ide o náhodný nález pri lekárskej prehliadke. Aj pri tomto priebehu syndrómu dlhého QT intervalu je však riziko náhlej srdcovej smrti v dôsledku fibrilácie komôr mnohonásobne vyššie ako u zdravého človeka. Preto si tento typ patológie vyžaduje starostlivé štúdium a preventívnu liečbu.
Diagnostika
Diagnóza syndrómu dlhého QT intervalu sa robí na základe štúdie pacientovej anamnézy, elektrokardiologických a molekulárne genetických štúdií. Pri výsluchu pacienta sa často zisťujú epizódy mdloby, závraty, búšenie srdca, ale v miernych formách patológie nemusia byť. Niekedy sa podobné prejavy vyskytujú u jedného z príbuzných pacienta, čo naznačuje rodinnú povahu ochorenia.
Pri akejkoľvek forme syndrómu dlhého QT sa zistia zmeny na EKG - zvýšenie intervalu QT na 0,6 sekundy alebo viac, je možné zvýšenie amplitúdy vlny T. Kombinácia takýchto znakov EKG s vrodenou hluchotou naznačuje prítomnosť Jervell-Lange-Nielsenov syndróm. Okrem toho je často potrebné Holterovo monitorovanie práce srdca počas dňa na identifikáciu možných záchvatov tachyarytmií. Definícia syndrómu dlhého QT pomocou metód modernej genetiky je v súčasnosti možná takmer pre všetky genetické typy tohto ochorenia.
Liečba syndrómu dlhého QT intervalu
Terapia syndrómu dlhého QT intervalu je pomerne komplikovaná, mnohí odborníci odporúčajú niektoré schémy pre túto chorobu a iné odmietajú, ale neexistuje jediný protokol na liečbu tejto patológie. Betablokátory sa považujú za univerzálne lieky, ktoré znižujú riziko vzniku tachyarytmií a fibrilácií, ako aj znižujú stupeň sympatického účinku na myokard, pri LQT3 sú však neúčinné. V prípade syndrómu dlhého QT typu 3 je rozumnejšie použiť antiarytmiká triedy B1. Tieto znaky liečby ochorenia zvyšujú potrebu molekulárno-genetickej diagnostiky na určenie typu patológie. V prípade častých atakov tachyarytmií a vysokého rizika rozvoja fibrilácie sa odporúča implantácia kardiostimulátora alebo kardioverter-defibrilátora.
Predpoveď
Prognóza syndrómu dlhého QT intervalu je podľa väčšiny odborníkov neistá, keďže toto ochorenie sa vyznačuje širokou škálou symptómov. Okrem toho absencia patologických prejavov, s výnimkou elektrokardiografických údajov, nezaručuje náhly rozvoj smrteľnej komorovej fibrilácie pod vplyvom vonkajších alebo vnútorných faktorov. Pri zistení syndrómu dlhého QT intervalu je potrebné dôkladné kardiologické vyšetrenie a genetické určenie typu ochorenia. Na základe získaných údajov sa vypracuje liečebný režim na zníženie pravdepodobnosti náhlej srdcovej smrti, prípadne sa rozhodne o implantácii kardiostimulátora.