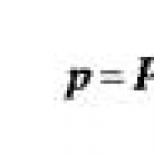Spôsob chirurgickej liečby odlúčenia pigmentového epitelu sietnice. Odlúčenie sietnice: príčiny, symptómy, liečba Kupolovité odlúčenie pigmentového epitelu s lokálnym defektom
 Vekom podmienená degenerácia makuly (AMD, senilná makulárna degenerácia, sklerotická makulárna degenerácia, involučná centrálna chorioretinálna dystrofia, vekom podmienená makulopatia, vekom podmienená degenerácia makuly, senilná makulárna degenerácia, AMD – vekom podmienená degenerácia makuly) je chronické degeneratívne ochorenie makulárnej zóny sietnice spojené s poškodením vrstvy choriokapilár, Bruchovej membrány, pigmentového epitelu sietnice a fotoreceptorovej vrstvy, spôsobujúce poruchu centrálneho videnia u pacientov nad 50 rokov.
Vekom podmienená degenerácia makuly (AMD, senilná makulárna degenerácia, sklerotická makulárna degenerácia, involučná centrálna chorioretinálna dystrofia, vekom podmienená makulopatia, vekom podmienená degenerácia makuly, senilná makulárna degenerácia, AMD – vekom podmienená degenerácia makuly) je chronické degeneratívne ochorenie makulárnej zóny sietnice spojené s poškodením vrstvy choriokapilár, Bruchovej membrány, pigmentového epitelu sietnice a fotoreceptorovej vrstvy, spôsobujúce poruchu centrálneho videnia u pacientov nad 50 rokov.
Jeho závažnosť je spôsobená centrálnou lokalizáciou procesu a spravidla bilaterálnymi léziami.
AMD je hlavnou príčinou nezvratnej straty zraku v rozvinutých krajinách a treťou najčastejšou príčinou nezvratnej straty zraku na celom svete. Je dokázané, že vznik VPMD súvisí s vekom: ak podiel ľudí s skoré prejavy tejto patológie vo veku 65-74 rokov je 15%, potom vo veku 75-84 rokov - už 25% a vo veku 85 rokov a starších - 30%. V súlade s tým je podiel ľudí s neskorými prejavmi AMD vo veku 65-74 rokov 1%; vo veku 75-84 rokov - 5%; vo veku 85 rokov a viac - 13 %. Prevládajúcim pohlavím pacientov je žena a u žien starších ako 75 rokov je táto patológia zaznamenaná dvakrát častejšie. V Rusku je výskyt AMD viac ako 15 na 1000 obyvateľov (8-10 miliónov z 29 miliónov obyvateľov vo veku 65 rokov a starších).
V blízkej budúcnosti nárast počtu ľudí nad 60 rokov nevyhnutne spôsobí nárast prevalencie AMD vo vyspelých krajinách. Takže podľa výpočtov Svetová organizácia zdravotnú starostlivosť, ak vezmeme do úvahy zvýšenie priemerného veku populácie do roku 2020, bude 80 miliónov ľudí na celom svete trpieť AMD. Podiel populácie staršej vekovej skupiny v ekonomicky vyspelých krajinách je v súčasnosti asi 20 % a do roku 2050 sa pravdepodobne zvýši na 33 %. V súlade s tým sa tiež očakáva významný nárast pacientov s AMD. To všetko nás núti považovať AMD za významný medicínsky a spoločenský problém, ktorý si vyžaduje aktívne riešenia.
Rizikové faktory
- Hlavným rizikovým faktorom pre rozvoj pokročilej AMD je Vek alebo skôr vekom podmienené involučné procesy. Riziko chorobnosti sa zvyšuje z 2 % vo veku 50 na 30 % u osôb nad 75 rokov.
- Fajčenie je jediným rizikovým faktorom, ktorého význam bol potvrdený v štúdiách. Fajčenie podľa rôznych zdrojov zvyšuje riziko AMD 2 až 6-krát u fajčiarov v porovnaní s tým, ktorí nikdy nefajčia. Zdá sa, že stupeň rizika spojeného s fajčením závisí od dávky: s pribúdajúcimi rokmi balenia sa zvyšuje riziko vzniku AMD. Odvykanie od fajčenia bolo spojené so zníženým rizikom AMD. Predpokladá sa, že fajčenie spôsobuje opakované oxidačné poškodenie tkanív (najmä vonkajšej vrstvy sietnice), znižuje hladinu antioxidantov v krvi na pozadí poklesu prietoku krvi v cievnatke. V dôsledku toho to vedie k toxickému poškodeniu retinálneho pigmentového epitelu (RPE).
- Rodinná anamnéza a genetické faktory . Riziko rozvoja pokročilej makulárnej degenerácie je 50 % u ľudí, ktorí majú príbuzných s AMD, oproti 12 % u ľudí, ktorí nemajú príbuzných s makulárnou degeneráciou. Genetické faktory sa považujú za jeden z kľúčových prediktorov AMD a naďalej sa skúmajú. Doteraz bol dokázaný vzťah choroby s génovými defektmi v komplementových proteínoch CFH, CFB a C3 a vedci z University of Southampton informovali o objave šiestich mutácií v géne SERPING1, ktoré sú spojené s makulárnou degeneráciou. Okrem toho v súčasnosti prebiehajú štúdie genetickej predispozície k rozvoju AMD (boli identifikované najmä zodpovedné gény ARMD1, FBLN6, ARMD3, HTRAI1).
- Žena - prevláda v štruktúre chorobnosti a u žien starších ako 75 rokov sa AMD vyskytuje 2-krát častejšie ako u mužov. Vo všeobecnosti je výskyt žien vyšší vzhľadom na ich dlhšiu priemernú dĺžku života. Okrem toho sa prevládajúca lézia žien po menopauze vysvetľuje stratou ochranného účinku estrogénov proti generalizovanej ateroskleróze. Neexistoval však žiadny dôkaz o priaznivom účinku hormonálnej substitučnej liečby.
- Existuje jasný vzťah medzi AMD a arteriálnej hypertenzie ako aj aterosklerotické vaskulárne lézie (najmä krčných tepien), hladina cholesterolu v krvi, cukrovka, nadváha. Podľa niektorých štúdií k rozvoju ochorenia prispieva strava s vysokým obsahom nasýtených tukov.
- Existujú náznaky možného vzťahu medzi nadmerné slnečné žiarenie a vekom podmienené poškodenie makuly. Možnosť škodlivého vplyvu slnečného žiarenia na makulu (najmä na modrú časť spektra) nie je známa všetkými výskumníkmi. Je však dokázané, že vysoké energie viditeľného svetla (z angl. High Energy Visible, HEV) môžu prispieť k rozvoju AMD.
- Jedným z faktorov, ktoré spôsobujú rozvoj mokrej makulárnej degenerácie, je ľudský cytomegalovírus . U pacientov s neovaskulárnou formou AMD teda štúdie odhalili zvýšenie titra protilátok proti ľudskému cytomegalovírusu, čo dalo dôvod predpokladať úlohu chronickej cytomegalovírusovej infekcie pri zvýšenej produkcii vaskulárneho endotelového rastového faktora (VEGF) aktivovanými makrofágmi. komplementovým systémom.
Patogenéza
S pribúdajúcim vekom sa medzi vrstvou retinálneho pigmentového epitelu (RPE) a Bruchovou membránou (hranica medzi RPE a cievnatkou) nachádzajú ložiskové ložiská lipofuscínu (glykolipoproteínová matrica), nazývané drúzy. Drúzy sa hromadia v dôsledku porušenia priepustnosti týchto štruktúr, zhoršenia ich zásobovania živiny a spomalenie vylučovania produktov metabolizmu z nich. V súčasnosti je dokázané, že vznik VPMD (a predovšetkým drúz) je založený na lokálnom zápale, ktorého patofyziologické mechanizmy sú podobné procesu tvorby aterosklerotických plátov. Nadmerné usadeniny drúz poškodzujú RPE a sprievodná chronická zápalová odpoveď vedie k ischémii tkaniva a buď k rozsiahlym oblastiam retinálnej atrofie alebo k expresii proteínov VEGF s rozvojom neovaskularizácie. Nakoniec sa vytvorí oblasť geografickej atrofie alebo rozsiahla subretinálna fibrózna jazva. Tieto procesy sú sprevádzané výraznou poruchou makuly s prudkým poklesom centrálneho videnia.
AMD je teda chronický degeneratívny (dystrofický) proces v RPE, Bruchovej membráne a choriokapilárnej vrstve. Ako je známe, RPE je polyfunkčný bunkový systém, ktorý vykonáva množstvo dôležité funkcie. PES sa podieľa najmä na tvorbe vonkajšej hematoretinálnej bariéry, absorpcii prebytočných svetelných kvant, fagocytóze použitých fotoreceptorových diskov (každý pigmentocyt fagocytuje 2000-4000 použitých diskov denne) s následnou obnovou membrány fotoreceptora, ako aj na syntéze a akumuláciu vitamínu A (retinolu), antioxidačnú ochranu tkanív pred voľnými radikálmi a inými toxínmi. Porušenie evakuácie produktov rozpadu, ktoré normálne prechádzajú cez Bruchovu membránu a sú odstraňované choriokapilárami, vedie k tvorbe veľkých molekulárnych reťazcov, ktoré nie sú rozpoznané enzýmami buniek pigmentového epitelu, nerozpadajú sa a hromadia sa vekom, tvoriace drúzy (obsahujúce lipofuscín). Lipofuscín ("pigment starnutia") sú okrúhle žltkasté granule s hnedým odtieňom, obklopené lipidovými membránami a majúce autofluorescenciu. Na druhej strane, granule lipofuscínu a s nimi spojený retinyl-retinylidénetanolamín sú fototoxické, pretože sú schopné generovať reaktívne formy kyslíka pod vplyvom svetla, čo vyvoláva peroxidáciu lipidov. Na druhej strane sietnica je veľmi citlivá na oxidačné poškodenie v dôsledku neustálej vysokej spotreby kyslíka pri takmer nepretržitom vystavení svetlu.
Pigmenty obsiahnuté v macula lutea (vo vnútorných vrstvách sietnice) a súvisiace s karotenoidmi plnia úlohu prirodzených slnečných okuliarov: absorbujú krátkovlnnú časť modrého svetla, čím sa podieľajú na antioxidačnej obrane makuly. Tento pigment, zložený z luteínu a zeaxantínu, slúži ako vysoko účinný inhibítor voľných radikálov. Zeaxantín je prítomný len v makule, luteín je distribuovaný po celej sietnici. Teraz existujú dôkazy, že nízke foveálne karotenoidy môžu byť rizikovým faktorom pre AMD.
S vekom sa zvyšuje aj hrúbka Bruchovej membrány, znižuje sa jej priepustnosť pre sérové proteíny a lipidy (fosfolipidy a neutrálne tuky). Zvýšenie lipidových usadenín znižuje koncentráciu rastových faktorov potrebných na udržanie normálnej štruktúry choriokapilár. Znižuje sa hustota choriokapilárnej siete, zhoršuje sa zásobenie buniek RPE kyslíkom. Takéto zmeny vedú k zvýšeniu produkcie rastových faktorov a matrixových metaloproteináz. Rastové faktory (VEGF-A a PIGF) prispievajú k patologickému rastu novovytvorených ciev a metaloproteinázy spôsobujú defekty v Bruchovej membráne. AMD teda začína suchou formou, teda zmenami v RPE a objavením sa tvrdých drúz. V neskoršom štádiu sa objavujú mäkké drúzy, potom sa menia na splývajúce. Progresívne poškodenie RPE vedie k atrofickým zmenám v retinálnom neuroepiteli a choriokapiláriách. S objavením sa defektov v Bruchovej membráne sa neovaskularizácia rozširuje pod pigmentový epitel a neurosenzorickú sietnicu. Spravidla je to sprevádzané edémom sietnice, hromadením tekutiny v subretinálnom priestore, subretinálnymi krvácaniami a krvácaniami v tkanive sietnice (niekedy v sklovci).
V budúcnosti, s nástupom neskorej fázy, môže ísť vývoj AMD dvomi cestami.
- Prvým spôsobom je geografická atrofia, relatívne pomaly progresívny proces. S nárastom počtu a veľkosti drúz, rozšírením dyspigmentačnej zóny, odumierajú fotoreceptory a narúša sa cievnatka, čo vedie k stenčovaniu cievovky a úplnej atrofii choriokapilárnej vrstvy, čím sa uzatvára začarovaný kruh.
- Druhým spôsobom je vznik choroidálnej neovaskularizácie (SNV), ktorá vedie k rýchlej a nezvratnej strate centrálneho videnia. Choroidálna neovaskularizácia je výsledkom nerovnováhy medzi vaskulárnym rastovým faktorom (VEGF) a vaskulárnym rastovým inhibičným faktorom (PEDF), ku ktorej dochádza v dôsledku oxidačného stresu. Porušenie permeability choriokapilárnej vrstvy, ku ktorému dochádza v štádiu drúz, vedie k zhoršeniu zásobovania vrstiev sietnice živinami a nedostatočnému odvodu produktov látkovej premeny. V dôsledku toho vzniká tkanivová ischémia, ktorá spôsobuje produkciu faktora VEGF a rast novovytvorených ciev. V prvom štádiu sa cievy tvoria na hranici RPE a vrstvy choriokapilár, potom môžu perforovať RPE, prenikajúc do subretinálneho priestoru. Exsudácia tekutiny cez cievnu stenu, krvácania z novovytvorených ciev vedú k exsudatívnemu a hemoragickému odlúčeniu RPE a neuroepitelu, čo spôsobuje smrť fotoreceptorov.
Hoci patogenéza vzniku suchej formy VPMD nie je úplne objasnená, moderné výdobytky molekulárnej genetiky, angiografie, histologické štúdie pomôcť pochopiť mechanizmus vývoja procesu. Atrofické ložiská sa môžu vyvinúť po exsudatívno-hemoragickom oddelení neuroepitelu alebo bez neho. V druhom prípade sa predpokladá, že rastúce drúzy sklovca tlačí na pigmentový epitel, v dôsledku čoho sa stenčuje, pigment mizne a medzi drúzami dochádza k jeho hyperplázii.
Súčasne sa v oblasti drúz určuje stenčenie Bruchovej membrány, v niektorých prípadoch s kalcifikáciou jej elastických a kolagénových častí. V choriokapilárnej vrstve dochádza k zhrubnutiu a hyalinizácii stromálneho tkaniva. Veľké cievnatky zostávajú nedotknuté. Tak sa vytvárajú ložiská atrofie pigmentového epitelu a choriokapilárnej vrstvy.
Klasifikácia

Rôzne názory na patogenézu ochorenia a vznik nových diagnostických metód určujú prítomnosť niekoľkých možností klasifikácie AMD (D. Gass (1965), LA Katsnelson (1973), Yu.A. Ivanishko (2006), Balashevich LI ( 2011) atď.). V praktickej oftalmológii je zvykom deliť VPMD na suchú a vlhkú formu. Suchá forma zahŕňa také prejavy ako drúzy, dyspigmentácia, atrofia RPE, choriokapilárna vrstva a geografická atrofia. Vlhká forma naznačuje prítomnosť choroidálnej neovaskularizácie a súvisiacich exsudatívnych a hemoragických komplikácií, ako je RPE a/alebo odlúčenie neuroepitelu.
V roku 1995 bola prijatá medzinárodná klasifikácia VPMD, podľa ktorej sa VPMD delí na skoré (vekom podmienená makulopatia) a neskoré formy (vekom podmienená makulárna degenerácia). Skoré formy naznačujú prítomnosť drúz, hyper- alebo hypopigmentácie. Neskoré formy sa v rôznych prejavoch delia na geografickú atrofiu a choroidálnu neovaskularizáciu.
najpohodlnejšie pre praktické uplatnenie v súčasnosti je klasifikácia VPMD navrhnutá prof. L. I. Balashevich a spoluautori v roku 2011. Táto klasifikácia zohľadňuje tak tradičné delenie VPMD na suchú a vlhkú formu, ako aj staging a rôzne varianty každej z foriem v súlade s modernými predstavami o patogenéze VPMD.
- Suchá (alebo neexsudatívna, predisciformná) forma AMD
- charakterizuje ju výskyt drúz v makulárnej zóne sietnice, defekty RPE, redistribúcia pigmentu, atrofia RPE a choriokapilárnej vrstvy.
Dipigmentácia (hypo- a hyperpigmentácia) makuly vyzerá ako oblasti so riedkym pigmentom, v kombinácii s rozptýlenými malými tmavohnedými časticami a zvyčajne nevedie k jasnému zníženiu zrakovej funkcie. Je spojená so zmenami vyskytujúcimi sa v RPE: proliferácia buniek v tejto vrstve, akumulácia melanínu v nich alebo migrácia buniek obsahujúcich melanín do subretinálneho priestoru. Fokálna hyperpigmentácia sa považuje za významný rizikový faktor pre výskyt choroidálnej (subretinálnej) neovaskularizácie (SNM). Lokálna hypopigmentácia často zodpovedá umiestneniu drúz, pretože vrstva RPE nad nimi sa stáva tenšou. Lokálnu hypopigmentáciu však môže určiť aj atrofia buniek RPE, ktorá nezávisí od drúz, alebo pokles obsahu melanínu v bunkách. Ako napredujete patologický proces dyspigmentácia môže progredovať do geografickej atrofie RPE. Ide o neskorú formu suchej AMD, ktorá sa prejavuje prítomnosťou dobre definovaných oblastí depigmentácie s dobre definovanými veľkými cievnatky (pripomínajúcimi kontinent v oceáne). Pri geografickej atrofii trpia okrem PES aj vonkajšie vrstvy sietnice a choriokapilárna vrstva v tejto zóne. Pri FA tvoria zóny atrofie defekt typu „okno“ a už v ranej fáze je jasne viditeľná choroidálna fluorescencia v dôsledku absencie pigmentu v zodpovedajúcich zónach RPE bez akumulácie a potenia. Geografická atrofia môže byť nielen samostatným prejavom VPMD, ale aj dôsledkom vymiznutia mäkkých drúz, sploštenia ložiska odchlípenia RPE, ba môže nastať aj v dôsledku regresie ložiska SNM. - Vlhká (alebo exsudatívna, diskovitá) forma AMD
:
- prevažne klasická choroidálna neovaskularizácia- klinicky sa prejavuje ako pigmentovaná alebo červenkastá štruktúra pod RPE, často sprevádzaná subretinálnymi krvácaniami. Pri FA sa novovzniknuté subretinálne cievy plnia skôr ako cievy sietnice (v predarteriálnej fáze) potením pod odlúčenou neurosenzorickou sietnicou. Krvácanie sietnice môže čiastočne chrániť SNM.
- minimálne klasická choroidálna neovaskularizácia;
- skrytá choroidálna neovaskularizácia bez klasickej zložky- podozrenie na fokálnu disperziu pigmentu so súčasným zhrubnutím sietnice, ktorá nemá jasné hranice. Pri FAH sa postupne (2-5 minút po injekcii) stáva viditeľnou „škvrnitou“ fluorescenciou, ktorej stupeň sa zvyšuje s pridávaním potenia (bez jeho zjavného zdroja). Zaznamenávajú tiež akumuláciu farbiva v subretinálnom priestore, ktorý nemá jasné hranice.
- podozrenie na choroidálnu neovaskularizáciu;
- angiomatózna proliferácia sietnice- má 3 štádiá: intraretinálna neovaskularizácia, subretinálna neovaskularizácia a fibrovaskulárne odlúčenie RPE, retinochoroidálna anastomóza. Vyznačuje sa demografickým profilom (vyšší vek, kaukazská rasa), vždy extrafoveolárnou lokalizáciou primárneho ložiska ("nekapilárna" zóna), častými intra- a preretinálnymi krvácaniami s následnou tvorbou SNM (bez charakteristickej hyperpigmentácie) a seróznym odchlípením RPE. Pri RAP sa vytvára sietnicovo-choroidálna anastomóza, to znamená, že sietnicová cieva sa rozširuje, prechádza hlboko do sietnice a končí v subretinálnom priestore novovytvorenými cievami.
- idiopatická polypoidná choroidovaskulopatia- ide o recidivujúce bilaterálne serózno-hemoragické odlúčenia PES (znak „laso“ na OCT je atypický charakter PES s vlnitým profilom). Charakteristický je výskyt siete rozšírených cievoviek s viacerými aneuryzmaticky končiacimi procesmi vo vnútorných vrstvách cievovky, čo dáva zmenám polypoidný vzhľad (častejší u žien rasy Negroid). Najčastejšie sa prejavuje v peripapilárnej zóne, nie je však nezvyčajná makulárna lokalizácia procesu. Pri oftalmoskopii sa prejavuje ako drusovité prominujúce ložiská, často s oblasťami odlúčenia RPE, krvácaním a tvrdými exsudátmi.
Serózne (exsudatívne) odlúčenie RPE je nahromadenie tekutiny medzi Bruchovou membránou a RPE a najčastejšie sa zisťuje v prítomnosti drúz a iných prejavov AMD (vrátane SNM). Jeho rozmery môžu byť rôzne. Na rozdiel od serózneho neuroepiteliálneho oddelenia má oddelenie RPE podľa optickej koherentnej tomografie (OCT) vzhľad kupoly s miernymi sklonmi. Zraková ostrosť môže zostať dosť vysoká, ale často dochádza k posunu refrakcie smerom k hypermetropii. Podľa FAG je oddelenie RPE charakterizované rýchlou, rovnomernou a pretrvávajúcou akumuláciou fluoresceínu od skorej (arteriálnej) fázy až po fázu recirkulácie bez potenia. Odlúčenie neuroepitelu často sprevádza odlúčenie RPE. S progresiou patologického procesu môže nastať sploštenie ohniska s tvorbou geografickej atrofie alebo prasknutie RPE s tvorbou SNM.
Choroidálna (subretinálna) neovaskularizácia (SNM) je charakterizovaná klíčením novovytvorených ciev cez defekty v Bruchovej membráne pod RPE alebo pod neuroepitelom. V tomto prípade patologická priepustnosť novovytvorených ciev vedie k úniku tekutiny, jej akumulácii v subretinálnych priestoroch a tvorbe edému sietnice. Neovaskularizácia môže viesť k objaveniu sa subretinálnych a intraretinálnych krvácaní. V tomto prípade existujú výrazné poruchy zraku. V SNM môže byť serózne odlúčenie RPE kombinované s jeho hemoragickým odlúčením.
Podľa lokalizácie sa choroidálna neovaskularizácia klasifikuje v závislosti od lokalizácie vo vzťahu k foveálnej avaskulárnej zóne.
- Subfoveal - 0 mikrónov - umiestnený pod stredom foveoly v avaskulárnej zóne
- Juxtafoveal - SNM alebo oblasť krvácania je v rozmedzí 1-199 µm od stredu foveálnej avaskulárnej zóny
- Extrafoveal - okraj SNM, zóna fluorescenčnej blokády pigmentom a/alebo krvácaním sú vo vzdialenosti ≥200 μm od stredu foveálnej avaskulárnej zóny
Klinický obraz
Pacienti s počiatočnými prejavmi suchej formy AMD sa môžu sťažovať na rozmazanie, postupné zhoršovanie centrálneho videnia, ťažkosti s čítaním, najmä pri slabom osvetlení, zníženú kontrastnú citlivosť a miernu metamorfopiu. Zároveň v niektorých prípadoch počiatočné formy AMD nemusia spôsobiť žiadne sťažnosti a môžu byť náhodnými nálezmi počas vyšetrenia fundusu.
Hlavným oftalmoskopickým znakom suchej formy AMD sú drúzy. Drúzy sa javia ako jednotlivé žlté inklúzie pod pigmentovým epitelom sietnice. Pevné drúzy sú malé zaoblené inklúzie izolované od seba s jasnými hranicami. Mäkké drúzy vyzerajú ako žlté inklúzie väčšej veľkosti so slabo rozlíšiteľnými okrajmi a tendenciou splývať. Prítomnosť jednotlivých malých tvrdých drúz s priemerom menším ako 63 mikrónov v makulárnej zóne je zvyčajne asymptomatická a vyskytuje sa u mnohých ľudí. Táto okolnosť sa nepovažuje za dostatočný dôvod na diagnostiku VPMD, mala by však slúžiť ako dôvod na ostražitosť a dynamické sledovanie s cieľom včas odhaliť progresiu procesu.
 Suché AMD
sa vyskytuje v 80-90% všetkých prípadov AMD. Poškodenie zraku zvyčajne začína skoro pri AMD, ktorá je oftalmoskopicky charakterizovaná viacerými malými drúzami a č Vysoké číslo stredne veľké drúzy (priemer 63-125 mikrónov) v kombinácii so zmenami v pigmentovom epiteli sietnice vo forme hyper- a hypopigmentácie. Výskyt metamorfopsie je spojený so zväčšením veľkosti drúz, výskytom mäkkých a splývajúcich drúz, čo zodpovedá strednému štádiu AMD (veľa stredne veľkých drúz a aspoň jedna veľká drúza s priemerom 125 μm) V zornom poli sú zaznamenané centrálne a paracentrálne skotómy, ktoré niekedy predchádzajú viditeľnej atrofii. Fluorescenčná angiografia odhaľuje vymiznutie choriokapilárnej vrstvy, zóny hyperfluorescencie zodpovedajúce oblastiam atrofie pigmentového epitelu a hypofluorescenciu v miestach jeho hyperplázie.
Suché AMD
sa vyskytuje v 80-90% všetkých prípadov AMD. Poškodenie zraku zvyčajne začína skoro pri AMD, ktorá je oftalmoskopicky charakterizovaná viacerými malými drúzami a č Vysoké číslo stredne veľké drúzy (priemer 63-125 mikrónov) v kombinácii so zmenami v pigmentovom epiteli sietnice vo forme hyper- a hypopigmentácie. Výskyt metamorfopsie je spojený so zväčšením veľkosti drúz, výskytom mäkkých a splývajúcich drúz, čo zodpovedá strednému štádiu AMD (veľa stredne veľkých drúz a aspoň jedna veľká drúza s priemerom 125 μm) V zornom poli sú zaznamenané centrálne a paracentrálne skotómy, ktoré niekedy predchádzajú viditeľnej atrofii. Fluorescenčná angiografia odhaľuje vymiznutie choriokapilárnej vrstvy, zóny hyperfluorescencie zodpovedajúce oblastiam atrofie pigmentového epitelu a hypofluorescenciu v miestach jeho hyperplázie.
Odlišná diagnóza uskutočnené so Sorsbyho centrálnou areolárnou choroidózou. Tieto ochorenia majú podobný oftalmoskopický obraz očného pozadia a dedičný charakter s autozomálne dominantným typom prenosu, avšak Sorsbyho choroidálna skleróza sa rozvíja vo viac nízky vek(20-30 rokov), v jeho klinický obraz neexistujú žiadne dominantné drúzy.
Podobný obraz fundusu možno pozorovať aj pri multifokálnej chorioretinitíde, najmä toxoplazmatickej etiológie, ktorej charakteristickým znakom sú jednostranné lézie, odlišná lokalizácia ložísk na funde a zápalová bunková reakcia v sklovci.
Stredná AMD tomu zodpovedá aj rozvoj geografickej atrofie, ktorá nezasahuje do centrálnej jamky. Za rizikové faktory progresie suchej formy VPMD sa považuje počet drúz viac ako 5, veľkosť viac ako 63 mikrónov, konfluentný charakter drúz a prítomnosť hyperpigmentácie. Oblasti geografickej atrofie vyzerajú ako dobre definované zaoblené oblasti atrofie RPE so stratou choriokapilár a stenčovaním cievovky, cez ktoré sa časom zviditeľnia veľké cievnatky.
Pri zapojení foveolárnej zóny do atrofického procesu dochádza k výraznému a nezvratnému poklesu zrakovej ostrosti. Tieto prejavy zodpovedajú neskorému štádiu suchej formy VPMD.
 Prvé príznaky vlhká AMD
v dôsledku vzniku SNM môže dôjsť k metamorfóze, pozitívnemu skotómu a „rozmazaniu“ centrálneho videnia. Bez liečby choroidálna neovaskularizácia rýchlo postupuje s veľmi zlou prognózou zraku.
Prvé príznaky vlhká AMD
v dôsledku vzniku SNM môže dôjsť k metamorfóze, pozitívnemu skotómu a „rozmazaniu“ centrálneho videnia. Bez liečby choroidálna neovaskularizácia rýchlo postupuje s veľmi zlou prognózou zraku.
Exsudatívne oddelenie pigmentového epitelu nastáva v dôsledku jeho oddelenia od Bruchovej membrány a je mierne vyčnievajúcim ohniskom okrúhleho, oválneho alebo podkovovitého tvaru. Lepšie ho definuje oftalmoskopia v odrazenom svetle. Najčastejšia lokalizácia je v makulárnej a paramakulárnej zóne. Na fluorescenčnom angiograme je serózna tekutina v oblasti exsudatívneho odlúčenia pigmentového epitelu skoro zafarbená fluoresceínom, čo spôsobuje ohnisko hyperfluorescencie s jasnými hranicami. Môže existovať odlúčenie pigmentového epitelu dlho bez dynamiky a samovoľne miznú alebo pribúdajú. Zároveň sú najčastejšími sťažnosťami pacientov výskyt sivastej škvrny pred okom, metamorfopsia, mikropsia a niekedy fotopsia. Zrakové funkcie sú mierne narušené, v zornom poli sa dajú zistiť relatívne skotómy. V niektorých prípadoch je oddelenie pigmentového epitelu asymptomatické. Jeho komplikáciou je prasknutie pigmentového epitelu, ku ktorému dochádza spontánne alebo v dôsledku laserovej koagulácie. V tomto prípade je zraková ostrosť výrazne znížená.
Exsudatívne odlúčenie neuroepitelu nemá jasné hranice a vzniká v dôsledku porušenia bariérovej funkcie pigmentového epitelu.Pacienti sa sťažujú na zahmlievanie centrálneho videnia, skreslenie a zmenu tvaru predmetov. Zraková ostrosť klesá výraznejšie ako pri odchlípení pigmentového epitelu a môže počas dňa kolísať. V zornom poli sa objavujú relatívne a absolútne skotómy. Na fluoresceínovom angiograme s oddelením neuroepitelu je na rozdiel od odlúčenia pigmentového epitelu pomalé farbenie transudátu a absencia jasných hraníc.
Vývoj subretinálnej neovaskulárnej membrány skrytej pod exsudátom nie je vždy možné diagnostikovať, existuje však množstvo oftalmoskopických symptómov, ktoré môžu naznačovať neovaskularizáciu, najmä zmena farby exfoliovaného neuroepitelu (špinavo sivý alebo mierne zelenkastý odtieň), výskyt perifokálnych krvácaní a ukladanie tuhého exsudátu. Významnú úlohu v diagnostike subretinálnej neovaskularizácie zohráva fluoresceínová angiografia, ktorá umožňuje sledovať vývoj choroidálnej neovaskularizácie. Pre jeho včasnú diagnostiku je dôležitá angiografia indocyanínovou zelenou, ktorá umožňuje odstrániť tieniaci efekt pigmentového epitelu a pozorovať zmeny cievovky. Subretinálna neovaskulárna membrána je v skorých fázach definovaná ako čipka alebo koleso bicykla. Fluoresceínový angiogram ukazuje klasické čipkované pozadie novovytvorených cievnatok. V neskorých fázach sa pozoruje dlhodobá svetlá extravazálna hyperfluorescencia v oblasti neovaskularizácie.
Podľa lokalizácie sa SNM typu I nachádza pod pigmentovým epitelom a typu II, ktorý zasahuje do subretinálneho priestoru. Typ I SUI je definovaný ako sivozelená alebo purpurovo žltá mierne vyvýšená lézia. Typ II SUI sa môže prejaviť ako subretinálna halo alebo pigmentovaná lézia. SNM sa tiež vyznačuje objavením sa znakov spojených s exsudáciou tekutiny: serózne odlúčenie sietnice, makulárny edém, usadeniny pevných exsudátov. SNM sa v budúcnosti môže skomplikovať hemoragickým odlúčením pigmentu a neuroepitelu, subretinálnymi krvácaniami, ktoré sa nakoniec zorganizujú do subretinálnej (diskovitej) jazvy, ktorá je sprevádzaná nezvratnou ťažkou stratou centrálneho videnia.často s ukladaním pigmentu . Bezpečnosť zrakových funkcií závisí od veľkosti a lokalizácie ohniska.
Ruptúra novovytvorených ciev vedie k subpigmentárnym, sub- a preretinálnym krvácaniam. V zriedkavých prípadoch je možný prienik krvácania do sklovca s rozvojom hemoftalmie. V budúcnosti dochádza k organizácii krvi a exsudátu s rastom vláknitého tkaniva a tvorbou jazvy.
Oftalmoskopicky viditeľné diskovité vyčnievajúce žltkasté ohnisko, sietnica nad ním je cysticky zmenená. Často sa pozdĺž okraja jazvy vytvorí sekundárne exsudatívne-hemoragické odlúčenie neuroepitelu a proces sa rozšíri do oblasti.
Odlišná diagnóza
Exsudatívne odlúčenie pigmentového epitelu môže byť symptómom nielen vekom podmienenej degenerácie makuly, ale aj centrálnej seróznej choriopatie (CSC) a možno ho pozorovať aj pri centrálnych zápalových procesoch. Rozdiel je v tom, že CSC sa vyznačuje nižším vekom pacientov (muži častejšie ochorejú), priaznivým výsledkom s obnovením zrakových funkcií a opakovaným priebehom ochorenia, zatiaľ čo vekom podmienená degenerácia makuly je charakterizovaná stabilne progresívny priebeh a prítomnosť dominantných drúz alebo iných dystrofických zmien súvisiacich s vekom v druhom oku.
Diferenciálna diagnostika s centrál zápalový proces na základe nižšieho veku pacientov, prítomnosti zápalovej bunkovej reakcie v sklovci a absencie zmien na oku.
Rozsiahly dystrofické zmeny, sprevádzané exsudatívnym odlúčením neuroepitelu, masívnymi exsudatívnymi ložiskami a hemorágiami s prominenciou sklovca, môže predstavovať obraz pseudotumoru. V týchto prípadoch echografia, fluoresceínová angiografia a absencia zmien na oku umožňujú stanoviť správnu diagnózu.
Diagnostika
Diagnostický algoritmus pre AMD zahŕňa stanovenie zrakovej ostrosti, biomikroskopiu (na identifikáciu iných možné príčiny objavenie sa symptómov, ako je šedý zákal súvisiaci s vekom, oftalmoskopia (vrátane štrbinovej lampy s použitím asférických šošoviek, ako aj Goldmanových, Mainsterových a iných šošoviek po rozšírení zreníc pri krátkodobo pôsobiacich mydriatikách), perimetria. Môžeme odporučiť aj štúdium vnímania farieb (monokulárne), Amslerov test. Za dôležité štúdie pri AMD sa považuje optická koherentná tomografia sietnice, fluoresceín (FA) alebo angiografia s indocyanínovou zelenou. Elektrofyziologické štúdie (ganzfeldova elektroretinografia, rytmická elektroretinografia, vzorová elektroretinografia, multifokálna elektroretinografia) sú tiež indikované pri AMD na posúdenie funkčného stavu postihnutej sietnice.
Pri anamnéze je potrebné brať do úvahy sťažnosti pacienta na zníženie zrakovej ostrosti, prítomnosť „škvrny“ pred okom, ťažkosti s čítaním, najmä pri slabom osvetlení (niekedy pacienti zaznamenajú stratu jednotlivých písmen pri plynulom čítaní), metamorfopsia. SNM sa vyznačuje sťažnosťami na prudký pokles videnia a metamorfopsie. Je dôležité venovať pozornosť trvaniu symptómov, jednostrannému alebo obojstrannému charakteru lézie, prítomnosti sprievodnej kardiovaskulárnej patológie a metabolických porúch, fajčeniu a dedičnosti.
Podľa fluoresceínovej angiografie môže byť choroidálna neovaskularizácia:
- Klasický - vyznačuje sa jasnými ažúrovými obrysmi, ktoré sa objavujú v najskorších fázach prechodu farbiva, v neskorších fázach dochádza k postupnému úniku fluoresceínu do subretinálneho priestoru okolo SNM.
- Skrytý (alebo okultný) – má menej zreteľný obrys, v skorých fázach angiografie nie sú hranice jasne viditeľné, v neskorších fázach dochádza k difúznemu alebo multifokálnemu presakovaniu.
V čistej forme sú tieto odrody SNM vzácne, vo väčšine prípadov ide prevažne o klasické alebo väčšinou skryté SNM.
Optická koherentná tomografia sietnice je nová neinvazívna metóda, ktorá umožňuje zobrazenie optických rezov sietnice pomocou skenovacieho laserového lúča. Metóda sa používa na diagnostiku, dynamické sledovanie a hodnotenie účinnosti liečby rôznych foriem VPMD. OCT umožňuje: posúdiť stav všetkých vrstiev sietnice, určiť závažnosť poškodenia RPE, výšku a oblasť makulárneho edému; všimnite si štrukturálne charakteristiky edému (cystické zmeny, oddelenie neuroepitelu); identifikovať prítomnosť neovaskulárnej membrány; identifikovať prítomnosť epiretinálnej fibrózy; určiť polohu zadnej hyaloidnej membrány sklovité telo; sledovať účinnosť liečby SNM a makulárneho edému; míňať odlišná diagnóza s inými ochoreniami sietnice. OCT sa odporúča vykonať pri prvej návšteve, následne: posúdiť dynamiku - s odstupom 6 mesiacov pri suchej makulárnej degenerácii, každý mesiac - pri SUI počas prvých šiestich mesiacov choroby; potom - v závislosti od zmien v sietnici.
S rozvojom technológie „hĺbkového“ skenovania (EDI – Enhanced Depth Imaging) pomocou spektrálnych optických tomografov sa objavili nové možnosti vo vizualizácii cievovky. Schopnosť preniknúť do retinálneho pigmentového epitelu (RPE) a vizualizovať cievnatka otvára nové hranice v chápaní patogenézy ochorení zadného segmentu oka. V prítomnosti submakulárnej neovaskulárnej membrány je hrúbka cievovky v priemere 234,2 ± 47,7 μm pre emetropickú refrakciu a 184,3 ± 56,5 μm pre myopickú refrakciu. Vzhľadom na tieto ukazovatele, osobitnú pozornosť označujú zmenšenie hrúbky cievovky druhého oka, keďže sa zvyšuje riziko vzniku SNM. Párové oči týchto pacientov by mali byť pozorované aspoň raz za 1-3 mesiace, čo umožní identifikovať SNM v počiatočných štádiách jeho vzniku a umožní včasné predpísanie terapie, ako aj udržanie vysokých zrakových funkcií.
OCT charakterizácia patognomických znakov AMD
- Pevné drúzy - malé, jasne diferencované, hyperreflexné, homogénne útvary, bez zníženia odrazivosti v strede; spôsobiť miernu eleváciu RPE, vonkajších segmentov fotoreceptorov a vrstvy IS/OS; môže poskytnúť mierny vertikálny tieň na podkladových vrstvách.
- Mäkké drúzy sú väčšie útvary s jasnými hranicami, zaobleným horným obrysom; v strede majú spravidla o niečo menšiu odrazivosť ako na hraniciach; Bruchova membrána je vizualizovaná; elevácia RPE, vonkajších segmentov fotoreceptorov a vrstvy IS/OS je výraznejšia, je možná deformácia vonkajších nukleárnych a retikulárnych vrstiev.
- Splývavé drúzy - ešte väčšie zlepence vzniknuté zlúčením mäkkých drúz, majú plochejší, nerovný, zvlnený horný obrys. Môžu dosiahnuť veľké veľkosti v oblasti aj vo výške.
V niektorých prípadoch, keď sa zlúči veľké množstvo drúz, a druzenoidné oddelenie RPE.
Atrofia pigmentového epitelu - stenčenie pigmentového epitelu v kombinácii s deštrukciou vonkajších vrstiev sietnice až po ich úplnú stratu; prudké stenčenie neuroepitelu v zóne atrofie. Známky atrofie RPE na OCT sú
- rednutie alebo úplná strata PES. V mieste RPE sa vizualizuje tenká čiara Bruchovej membrány;
- rednutie resp úplná absencia vonkajšia jadrová vrstva (v najťažších prípadoch);
- priamy kontakt vonkajšej plexiformnej vrstvy s Bruchovou membránou;
- relatívne zvýšenie odrazivosti vrstvy choriokapilár za oblasťou atrofie v dôsledku porušenia svetloabsorbujúcej funkcie RPE.
OCT angiografia je moderná neinvazívna metóda vizualizácie mikrovaskulárneho lôžka v oftalmológii, ktorá rozširuje možnosti OCT vďaka schopnosti odlíšiť cievy od okolitých tkanív v celej hĺbke skenovania bez použitia kontrastnej látky. Vizualizácia cievneho riečiska sietnice a cievovky je založená na registrácii pohybu krvi v lúmene cievy a je prezentovaná vo forme máp cievnych štruktúr vo vrstve sietnice, pigmentového epitelu alebo cievnatky, ktorá je vyšetrovaný. Použitie OCT angiografie pri AMD umožňuje odhaliť zmeny nielen v oblasti neovaskulárneho komplexu, ale aj v hustote, hrúbke novovytvorených ciev a povahe ich vetvenia, aby sa odlíšili klasické a latentné typov SNM a posúdiť dynamiku oblasti neovaskulárneho komplexu počas anti-VEGF terapie. Avšak angioOCT v diagnostike AMD hrá úlohu pomocnej štúdie a nenahrádza FAG.
intraretinálne depozity - vizualizované ako hyperreflexné útvary, zvyčajne nesúvisiace s PES. Vklady môžu byť umiestnené pred PES, vedľa PES alebo priamo v hrúbke PES. Na rozdiel od drúz, intraretinálne ložiská nie sú spojené s Bruchovou membránou a najčastejšie predstavujú lipofuscínové granuly rôznych veľkostí. Usadeniny sa môžu šíriť aj do vnútorných vrstiev neuroepitelu, čo spôsobuje ich deštrukciu.
Exsudatívne oddelenie pigmentového epitelu - kupolovitý útvar s jasným, až hyperreflexným obrysom, ktorý zodpovedá PES. Obsah je zvyčajne hypo- alebo reflexný. Bruchova membrána je vizualizovaná ako tenká, mierne reflexná čiara. charakteristický znak: pripojenie RPE k Bruchovej membráne na hranici zóny odlúčenia nastáva pod uhlom väčším ako 45°.
Exsudatívne oddelenie neuroepitelu - hromadenie hypo- alebo nereflexného obsahu, čo je serózna tekutina, ktorá vyteká z defektných novovytvorených ciev pod neuroepitelom. Obrys vonkajších vrstiev neuroepitelu nad tekutinou môže byť nerovný a nezreteľný. Charakteristický znak: pripojenie neuroepitelu k RPE na hranici zóny odlúčenia prebieha pod uhlom menším ako 30°.
Choroidálna neovaskulárna membrána - je vizualizovaný na OCT, ak je SNM typu II, t.j. je prevažne klasická. Klasická subretinálna SNM má vzhľad stredného reflexného útvaru s neostrými hranicami, ktorý sa nachádza medzi RPE a neuroepitelom. Spravidla je obklopený reflexnými alebo hyporeflexnými obsahmi exsudatívneho charakteru. Charakteristické znaky OCT klasickej choroidálnej neovaskularizácie sú:
- zväčšenie hrúbky sietnice vo fovee, deformácia alebo zmiznutie foveálnej depresie;
- intraretinálna tekutina vo forme cystických dutín a / alebo hemoragických inklúzií;
- prítomnosť heterogénnej strednej reflexnej formácie s fuzzy hranicami, ktorá sa nachádza medzi neuroepitelom a RPE;
- exsudatívne oddelenie neuroepitelu.
Latentná choroidálna neovaskularizácia (SNM typ I, subpigmentový epiteliálny, okultný, skrytý) nie je priamo viditeľný na OCT, ale jeho prítomnosť je v 98% prípadov sprevádzaná viac či menej výrazným odlupovaním RPE, pod ktorým je v niektorých prípadoch mierne stredný reflexný obsah. je vizualizovaný. Pre spoľahlivejšie vymedzenie klasického a latentného SNM sa odporúča použiť FAG a OCTA, ktoré umožňujú presne určiť, na ktorej vrstve sa SNM nachádza.
Elektroretinografia
Študovať povahu funkčných zmien sietnice v rôznych štádiách vekom podmienenej degenerácie makuly a kontrolovať progresiu procesu najvyššia hodnota majú výsledky elektroretinografie a (pri včasnej diagnóze) elektrookulografie.
Zmeny na elektrookulograme (EOG) sa vysvetľujú zapojením väčšej časti pigmentového epitelu sietnice do patologického procesu, ako je stanovené oftalmoskopicky. Avšak G.A. Fishman (1976) pozoroval normálny EOG u veľkého počtu pacientov s vekom podmienenou degeneráciou makuly, čo mu umožnilo navrhnúť miesto zmien v tomto type patológie.
- Včasné zmeny zrakových funkcií u pacientov s AMD možno zistiť pomocou psychofyzikálnych metód na štúdium adaptácie na tmu, citlivosti sietnice na svetlo, farbu a kontrast.
- Skoré zmeny v zornom poli sa zisťujú pomocou Amslerovej mriežky skúmaním priestorovej kontrastnej citlivosti.
- Zmeny v zornom poli môžu byť prvým príznakom nahromadenia subretinálnej tekutiny v makulárnej oblasti.Skreslenie predmetov, rozmazané videnie, ťažkosti s čítaním sú najčastejšími príznakmi ochorenia.
- Farebné videnie zvyčajne nie je ovplyvnené, pokiaľ je fovea neporušená. Červeno-zelená dichromázia je už zaznamenaná v skoré štádia ochorenia, a zmeny citlivosti v zeleno-modrej časti spektra – v pokročilom štádiu procesu. Tieto zmeny vo farebnom videní však nie sú špecifické pre vekom podmienenú degeneráciu makuly.
- Zmeny v topografii kontrastnej citlivosti a zníženie aktivity zapnutia/vypnutia kužeľového systému na podnety svetlejšie ako pozadie sa zisťujú už v ranom štádiu ochorenia.
Elektroretinografické výskumné metódy zahŕňajú analýzu všeobecného, makulárneho a rytmického elektroretinogramu (ERG, MERG a RERG) a ERG pre reverzné šachové vzory (vzor ERG). Ukázalo sa tiež, že spolu s EOG je pre včasnú diagnostiku zmien v pigmentovom epiteli sietnice informatívna registrácia c-vlny ERG.
Patologický EOG je u väčšiny pacientov zachytený už vo včasných štádiách ochorenia, pričom celkový ERG zostáva dlhodobo na úrovni spodnej hranice vekovej normy alebo je zaznamenaný mierne subnormálne. Výraznejší pokles ERG vĺn je zistený u starších ľudí, u ktorých sa choroba pozoruje už mnoho rokov.
ERG je spravidla normálne v štádiu dominantných drúz. Predtým A.E. Kril a V.A. Klein (1965) odhalil subnormálnu povahu a- a b-vĺn ERG u pacientov s dominantnými drúzami, dokázali však obnovenie amplitúdy ERG vĺn v procese adaptácie na tmu, čo naznačuje zachovanie funkcie skotopického systému v počiatočných štádiách AMD.
Podľa výsledkov ERG funkčné poruchy vo vonkajšej a vnútornej vrstve sietnice v viac vyjadrené v pokročilých a pokročilých štádiách makulárnej degenerácie spojenej s vekom, s disciformnými formami dystrofie, ako je Kunt-Junius, odlúčenie pigmentového epitelu, keď je ERG b-vlna subnormálna. Súčasne sú na funduse pacientov zaznamenané atrofické zmeny v chorokapilárnej vrstve a pigmentovom epiteli, výrazné sklerotické zmeny v cievach sietnice, ktoré, keďže nie sú patognomickým znakom VPMD, môžu byť aj príčinou subnormálneho charakteru ERG v dôsledku metabolických porúch v sietnici. V literatúre sú opísané aj prípady, kedy boli zaznamenané prudko patologické ERG a EOG, čo sa vysvetľuje starými okluzívnymi léziami venózneho riečiska pozorovanými pri VPMD, diskiformným odchlípením pigmentového epitelu, diabetickou retinopatiou, generalizovanou hypopigmentáciou a „geografickou“ atrofiou pigmentu. epitel.
Treba si uvedomiť aj to, že miera zmien amplitúdy celkového ERG závisí od intenzity použitého podnetu a výrazné odchýlky biopotenciálov od normy sa zisťujú pri svetelných zábleskoch nižšieho jasu. Na získanie elektroretinografickej charakterizácie rôznych štádií makulárnej degenerácie súvisiacej s vekom sa použila zvýšená citlivosť elektroretinografie pri detekcii jemných funkčných porúch sietnice pri strednej intenzite svetelnej stimulácie. Spoľahlivé rozdiely v amplitúde b-vlny celkového ERG od spodnej hranice normálnych hodnôt boli zistené až v pokročilých a pokročilých štádiách ochorenia. Avšak u 43 % pacientov s počiatočná fáza AMD (neexsudatívna forma) odhalila supresiu ERG a-vlny, ktorej hodnota nepresiahla 80% nižšej normy a v 70% - inhibíciu vysokofrekvenčného REG pri stimulácii s frekvenciou 40 Hz.
Makulárna ERG (MERG) má najväčšiu diagnostickú hodnotu pri vyšetrovaní pacientov s vekom podmienenou degeneráciou makuly, pretože tento funkčný test odráža aktivitu neurónov kužeľového systému makulárnej oblasti, a preto miera zmien MERG závisí od povaha štrukturálnych a metabolických porúch v centrálnej oblasti.sietnica. Prakticky sa nemení s drúzami a počiatočnou formou chorioretinálnych zmien, avšak s vývojom ochorenia MERG postupne klesá, čo odráža zložitejšie deštruktívne procesy v makulárnej oblasti sietnice.
Vysokofrekvenčný rytmický ERG (RERG) je celková aktivita celého kužeľového systému sietnice, ktorá priamo neodráža elektrogenézu jej centrálnej časti, avšak pri miernej intenzite stimulujúceho svetla (15–20 cd/m2) významne sa zvyšuje príspevok aktivity makulárnej oblasti (až o 25 % amplitúdy celkovej rytmickej odpovede), čím sa zvyšujú diagnostické možnosti REG. Stupeň inhibície ERRG u neexsudatívnych foriem AMD je nižší ako u MERG, ale prudko sa zvyšuje pri dysciformných a exsudatívno-hemoragických formách ochorenia. Navyše, v skorých štádiách AMD je makulárny edém často sprevádzaný normálnym alebo supernormálnym MERG. Súčasne je amplitúda vysokofrekvenčného RERG znížená viac ako 2-krát v porovnaní so spodnou hranicou normálnych hodnôt.
ERG reverzného vzoru je menej bežná metóda diagnostiky AMD. Používa sa na objektívne hodnotenie zrakovej ostrosti sietnice (RIV), najmä na sledovanie účinnosti laserovej koagulácie subfoveálnych neovaskulárnych membrán a progresie vekom podmienenej degenerácie makuly. Hodnotenie ROS sa vykonáva výpočtom pomeru logaritmu priestorovej frekvencie stimulu (veľkosť šachovnicovej bunky) k amplitúde vzoru ERG.
Liečba
Ciele terapie:
- dosiahnutie stabilizácie patologického procesu, a nie zlepšenie videnia - v prítomnosti SNM;
- prevencia komplikácií (pri suchej forme - výskyt SNM, pri vlhkej forme - výskyt krvácaní rôznej lokalizácie, zvýšený edém sietnice atď.);
- prevencia závažnej straty zraku vedúcej k invalidite;
- zachovanie zrakovej ostrosti, umožňujúce pacientovi samostatne sa obsluhovať v prípade pokročilej patológie.
Pri suchej forme VPMD sa používajú lieky na zlepšenie regionálneho prekrvenia (vinpocetín 5 mg 3x denne perorálne v 2-mesačných kúrach, pentoxifylín 100 mg 3-krát denne perorálne v 1-2 mesačných kúrach, extrakt z listov ginkgo biloba 1 tableta 3-krát denne perorálne v 2-mesačných cykloch). Dnes však ich používanie ustupuje do úzadia, keďže mnohí autori spochybňujú teóriu obehového zlyhania ako hlavného etiopatogenetického faktora vzniku VPMD. Pri tejto forme AMD sa využíva aj stimulačná terapia. Je možné použiť lieky s odlišným mechanizmom účinku - napríklad peptidové bioregulátory a najmä polypeptidy sietnice očí hovädzieho dobytka (retinalamín).
Ako bolo uvedené vyššie, vystavenie slnečnému žiareniu prispieva k objaveniu sa voľných radikálov, polynenasýtených mastných kyselín vo vonkajších vrstvách sietnice, v RPE a Bruchovej membráne. V tejto súvislosti boli urobené pokusy znížiť vplyv oxidačného stresu zavedením do stravy pacientov biologicky aktívnych potravinových doplnkov obsahujúcich antioxidanty: karotenoidy, vitamíny, luteín, zinok, meď. Medzi najlepšie preskúmané antioxidanty patria vitamíny C a E, betakarotén, karotenoidy (luteín a zeaxantín) a polyfenoly. Pozornosť odborníkov upútal aj zinok, ktorý je súčasťou štruktúry kľúčového enzýmu prvej línie antioxidačnej ochrany - zinku, meď-dependentnej superoxiddismutázy (Cu,Zn-SOD). Superoxiddismutáza katalyzuje dismutáciu superoxidu na kyslík a peroxid vodíka, čím inhibuje tvorbu peroxydusitanu, ktorý je nebezpečný pre očné tkanivá (vrátane PES). Rastlinné karotenoidy (luteín a zeaxantín) sa hromadia v makule a blokujú škodlivé účinky ultrafialovej časti sveta. Pôsobia ako silné antioxidanty, blokujú pôsobenie voľných radikálov, ktoré poškodzujú očné tkanivo a prispievajú k strate zraku. Vitamíny C a E sú považované za najbežnejšie antioxidanty, ktoré zosilňujú a dopĺňajú svoje pôsobenie, chránia očné tkanivá pred poškodením, pomáhajú obnoviť zrakové pigmenty (rodopsín atď.) tyčiniek a čapíkov zodpovedných za normálne vnímanie svetla a farieb. Tiež posilňujú steny a zvyšujú elasticitu. cievy vrátane ciev fundusu. Zúčastnite sa tkanivového dýchania a iných procesov bunkového metabolizmu. Majú neuroprotektívny účinok. Zinok, meď, selén sú nevyhnutné stopové prvky na udržanie funkcie zraku, pôsobia aj antioxidačne, kompenzujú nepriaznivé vplyvy prostredia. Pomáhajú zlepšiť výživu očného pozadia a udržiavať funkčný stav zrakových nervov.
Napríklad výsledky randomizovanej štúdie AREDS o používaní rôznych prídavné látky v potravinách vykazujú pozitívne účinky na rýchlosť progresie VPMD - spomalenie o 25 % - z užívania vysokých dávok antioxidantov (vitamíny C, E, β-karotén a zinok), zníženie pravdepodobnosti poškodenia zraku (3 riadky) o 19 %.
Príkladom takéhoto doplnku stravy je Retinorm s obsahom 10 mg luteínu, 2 mg zeaxantínu, 500 mg vitamínu C, 150 mg vitamínu E, 100 µg selénu, 25 mg zinku a 2 mg medi (meď a zinok sú vo forme asparaginátov, ktoré poskytujú vysokú biologickú dostupnosť mikroživín). Zloženie Retinormu je vyvinuté na základe vzorca AREDS2 - najväčšej klinickej multicentrickej štúdie uskutočnenej pod záštitou Národný inštitút US oči (6 rokov - 4203 pacientov s AMD, 82 zdravotnícke strediská), čo potvrdilo pozitívny vplyv luteín (10 mg) a zeaxantín (2 mg) v kombinácii s vysokými dávkami vitamínov C (500 mg) a E (268 mg), stopovými prvkami (zinok 25 mg a meď 2 mg) na zníženie progresie VPMD. Luteín/zeaxantín viedol k 11 % zníženiu rizika neovaskularizácie a 10 % zníženiu pokročilej AMD. Pri nahradení β-karoténu vo vzorci AREDS luteínom + zeaxantínom bolo pozorované dodatočné zníženie rizika rozvoja pokročilej VPMD z 34 na 30 % a tiež sa eliminoval problém s rakovinou u fajčiarov (β-karotén je karcinogén a neodporúča sa fajčiarom) v porovnaní s výsledkami AREDS.
V súčasnosti pre laserová stimulácia sietnice častejšie sa používa hélium-neónový laser s vlnovou dĺžkou 632 nm, hélium-kadmiový laser (441 nm) a infračervené laserové žiarenie (1,3 mikrónu). Predpokladá sa, že laserová stimulácia sietnice je indikovaná pre všetky prejavy neexsudatívnej formy AMD, s výnimkou drúz sietnice. Zvlášť indikovaná je laserová koagulácia mäkkých konfluentných drúz lokalizovaných obojstranne, pri ktorých sa najčastejšie rozvíja choroidálna neovaskularizácia. Napriek tomu, že po laserkoagulácii počet drúz klesá a dochádza k ich splošteniu, podľa literatúry sa v 3 % prípadov 5-11 mesiacov po laserovej koagulácii rozvinie choroidálna neovaskularizácia.
Efektívnejšia laserová koagulácia sietnice pri liečbe exsudatívnych a exsudatívno-hemoragických štádií AMD. Používa sa na zníženie opuchu makulárnej oblasti, deštrukciu subretinálnej neovaskulárnej membrány, ohraničenie alebo „uzavretie“ odchlípení exsudatívneho pigmentového epitelu.
Základný princíp laserovej koagulácie v týchto patologické stavy- celistvosť fovey; v tejto zóne je možné vykonať laserovú koaguláciu iba v prípadoch, keď je zachované extrafoveálne videnie a ožiarenie makuly zastaví dystrofický proces. Na koaguláciu centrálnej zóny sa používajú argónové, kryptónové a diódové lasery. Podľa L.A. Katsnelson a kol. (1990) je v tejto zóne účelnejšie vykonávať laserovú koaguláciu pomocou zdroja kryptónovej červene s vlnovou dĺžkou 647 nm, keďže sa absorbuje vo vrstve pigmentového epitelu s minimálnym poškodením sietnice.
Načasovanie expozície laserom je určené stavom zrakových funkcií a povahou zmien v makule. V prípade exsudácie a poškodenia zraku je vhodné vykonať fluoresceínovú angiografiu a ak je to indikované, laserkoaguláciu. Pri exsudatívnom odlúčení retinálneho pigmentového epitelu (RPE) v makulárnej zóne sa vykonáva bariérová laserová koagulácia vo forme "podkovy" otvorenej smerom k papilomakulárnemu zväzku. Exsudatívne odlúčenie pigmentového epitelu mimo makulárnej oblasti je úplne "uzavreté" koagulátmi. Pri rozšírenom exsudatívnom oddelení neuroepitelu je potrebná "mriežková" laserová koagulácia v centrálnej zóne sietnice. V prítomnosti choroidálnej alebo subretinálnej neovaskulárnej membrány sa odporúča úplné uzavretie patologického ložiska laserovou koaguláciou. III stupňa. V tomto prípade je potrebné vziať do úvahy lokalizáciu neovaskulárnej membrány a jej vzdialenosť od avaskulárnej zóny.
Prognóza účinnosti laserovej operácie sa zhoršuje, keď sa odlúčenie RP kombinuje s lokálnou choroidálnou neovaskularizáciou, najmä ak je lokalizovaná priamo pod oblasťou odlúčenej RP. Parapapilárne usporiadanie choroidálnej neovaskularizácie zároveň často dosahuje najlepšie anatomické a klinické výsledky.
IN posledné roky povzbudivé výsledky sa získali aj použitím diódových laserov a fotodynamickej terapie na koaguláciu choroidálnych neovaskulárnych membrán, ako aj nízkodávkovou rádioterapiou na liečbu subfoveálnej neovaskularizácie.
Medikamentózna liečba choroidálnej (subretinálnej) neovaskularizácie
Účinnou liečbou neovaskulárnej AMD je použitie inhibítorov neovaskulárneho rastového faktora – liekov proti VEGF. V Rusku je v súčasnosti povolené používať na liečbu SUI dva lieky, aflibercept a ranibizumab. Vzhľadom na skutočnosť, že VEGF je hlavným faktorom stimulujúcim subretinálnu neovaskularizáciu pri vlhkej AMD, antiangiogénna terapia sa stala základným prvkom jej liečby, pretože sa považuje za patogeneticky orientovanú a bezpečnú. Inhibítory VEGF vykazujú lepšie výsledky zrakovej ostrosti v porovnaní s inými liečbami a stali sa lieky prvej voľby v liečbe neovaskulárnej AMD. Ako ukazujú výsledky viacerých klinických štúdií, vyhliadky na terapiu priamo závisia jednak od jej včasného začatia (čím skôr sa liečba začne, tým lepší je výsledok, terapeutické okno na začatie liečby je až 12 mesiacov od začiatku choroby) ao povinnom monitorovaní. Na posúdenie účinnosti a včasné zistenie potreby opakovanej terapie je potrebný mesačný monitoring (podľa návodu sa odporúčajú 3 po sebe nasledujúce mesačné injekcie a následne podanie lieku „na želanie“), ktoré nevyhnutne zahŕňa visometriu a OCT makula.
Pri vlhkej forme VPMD možno na zníženie edému použiť subkonjunktiválne a retrobulbárne injekcie glukokortikoidov (dexametazón 0,5 ml, triamcinolón 1,0 ml 10 injekcií) a vo forme subkonjunktiválnych injekcií acetazolamid perorálne (250 mg 1-krát denne v ráno pol hodiny pred jedlom po dobu 3 dní, potom po 3-dňovej prestávke možno kurz zopakovať), ako aj intravitreálnu injekciu implantátu s predĺženým dexametazónom.
Laserová liečba subretinálnej neovaskularizácie
V niektorých situáciách slúžia ako metóda voľby laserové techniky, ktorých účelom je znížiť riziko ďalšieho poklesu zrakovej ostrosti u pacienta. Za týmto účelom je subretinálna neovaskulárna membrána úplne zničená v zdravých tkanivách aplikáciou intenzívnych konfluentných koagulátov. Na zničenie „klasických“ extrafoveolárnych SNM je možné použiť argónovú laserovú koaguláciu, čím sa zníži pravdepodobnosť ich rozšírenia do foveoly a závažnej straty zraku. Pre juxtafoveálne subretinálne membrány sa odporúča kryptónový červený laser. Pri subfoveolárnych membránach sa používa fotodynamická terapia. Zásah by sa mal vykonávať podľa výsledkov FAG. Využitie techniky je limitované nízkou prevalenciou týchto lokalizácií SNM (13-26 %), výrazným škodlivým účinkom a vysoké riziko membránová recidíva.
Transpupilárna termoterapia – nízkoenergetická laserová expozícia(vlnová energia infračervenej časti spektra s dĺžkou 810 nm), navrhnutá pre biostimulačný efekt na latentné SNM (s minimálnou klasickou zložkou) centrálnej lokalizácie. Plošné zavedenie metódy sa však ukázalo ako nemožné pre krátke trvanie terapeutického účinku, riziko komplikácií (hemorágie, ruptúra RPE, oklúzia ciev sietnice, progresia fibrózy atď.) a značný počet kontraindikácií (klasická zložka SNM, predchádzajúca laserkoagulácia, odlepenie RPE a pod.). Transpupilárna termoterapia sa môže použiť v prípadoch, keď prakticky nedochádza k pozitívnemu účinku fotodynamickej terapie (PDT). Pri použití transpupilárnej termoterapie sú však zaznamenané časté komplikácie spojené predovšetkým s predávkovaním laserovou energiou (normálne by mal byť účinok podprahový): infarkty v makulárnej zóne, oklúzia sietnicových ciev, RPE ruptúry, subretinálne krvácania a atrofické ložiská v cievnatka sú popísané. Zaznamenal sa aj rozvoj katarakty a tvorba zadnej synechie.
Nízkoenergetická argónová laserová koagulácia drúz na prevenciu progresie ochorenia a rozvoja SNM bola študovaná v 90. rokoch (Choroidal Neovaskularizácia Prevention Trial). Metóda je relatívne bezpečná a poskytuje dobré okamžité výsledky, avšak z dlhodobého hľadiska je vysoká pravdepodobnosť vzniku subretinálnych neovaskulárnych membrán v oblastiach vystavenia laseru. V súčasnosti sa metóda aktívne nepoužíva.
Fotodynamická terapia
Ide o spôsob selektívneho ovplyvnenia SNM žiarením diódového lasera s vlnovou dĺžkou 689 nm (trvanie 83 s). Predvyrobené intravenózne podanie fotosenzitívna látka verteporfín - 6 mg/kg telesnej hmotnosti po dobu 5 minút, ktorá sa selektívne hromadí v endoteli novovytvorených ciev, čo spôsobuje ich trombózu a obliteráciu. Laserové žiarenie teda selektívne poškodzuje cieľové tkanivo bez ovplyvnenia okolitých štruktúr, čo vedie k uzáveru ciev a spomaleniu progresie SIU. Keďže po vaskulárnej oklúzii môže dôjsť k rekanalizácii, pacienti potrebujú v priemere 5-6 sedení PDT (viac ako polovica z nich sa uskutoční do 1 roka od začiatku liečby).
Je preukázaná účinnosť PDT v klasickej a prevažne klasickej SNM (vrátane subfoveolárnej lokalizácie) s plochou do 5400 µm. Pri pretrvávaní činnosti SNM sa procedúry opakujú každé 3 mesiace. Vyhliadky na použitie PDT s veľkosťou membrány 5400 μm, počiatočná zraková ostrosť<0,1, cкрытых и минимально классических СНМ сомнительны. На сегодняшний день ФДТ чаще рассматривается не как самостоятельный способ лечения, а как дополнение к более эффективной терапии ингибиторами ангиогенеза. В России данный вид терапии практически не используется. В последнее время ФДТ реже применяют в тех странах, где разрешено интравитреальное введение ингибитора ангиогенеза.
Chirurgická liečba choroidálnej (subretinálnej) neovaskularizácie
Submakulárna chirurgia, makulárna translokácia, transplantácia cievovky, transplantácia buniek RPE a iné techniky sa tiež veľmi nepoužívajú. Je to spôsobené ich výraznou technickou náročnosťou, rizikom závažných komplikácií a nízkymi funkčnými výsledkami (zraková ostrosť dlhodobo aj po úspešnom zákroku len málokedy prekročí 0,1).
Pri odstránení subretinálnych neovaskulárnych membrán sa najskôr štandardnou technikou vykoná vitrektómia, potom sa paramakulárne, z temporálnej strany, vykoná retinotómia. Vyvážený fyziologický roztok sa vstrekuje cez otvor na retinotómiu, aby sa oddelila sietnica. Potom sa pomocou horizontálne zakriveného vrcholu membrána mobilizuje a membrána sa odstráni vedením horizontálne zakrivenej pinzety cez retinotómiu. Výsledné krvácanie sa zastaví zdvihnutím fľaše s infúznym roztokom a tým zvýšením vnútroočného tlaku (IOP). Vykonajte čiastočnú výmenu kvapaliny vzduchom. V pooperačnom období musí pacient pozorovať nútenú polohu tvárou nadol, kým sa vzduchová bublina úplne nevstrebe. Takéto zásahy môžu znížiť metamorfopiu, poskytnúť trvalejšiu excentrickú fixáciu, čo pacienti často považujú za subjektívne zlepšenie videnia. Hlavnou nevýhodou je nedostatočné zlepšenie zrakovej ostrosti v dôsledku zásahu (vo väčšine prípadov po operácii nepresahuje 0,1).
Boli vyvinuté techniky na odstránenie masívnych subretinálnych krvácaní ich evakuáciou cez retinotomické otvory.
Vykonávajú aj operáciu translokácie makuly. Hlavnou myšlienkou takéhoto zásahu je vytesnenie neuroepitelu foveálnej zóny sietnice umiestnenej nad SNM tak, aby nezmenená RPE a choriokapilárna vrstva boli v novej polohe pod ňou. Ak to chcete urobiť, najskôr vykonajte medzisúčet vitrektómie a potom úplne alebo čiastočne odlupujte sietnicu. Operáciu je možné vykonať s retinotómiou po celom obvode (360°) s následnou rotáciou alebo posunom sietnice, ako aj vytvorením záhybov (t.j. skrátením) skléry. Potom sa sietnica „zafixuje“ v novej polohe pomocou endolaseru a neovaskulárna membrána sa zničí pomocou laserovej koagulácie. Vykonáva sa pneumoretinopexia, po ktorej musí pacient počas dňa pozorovať nútenú polohu (tvárou nadol). Pri zákrokoch na translokáciu makuly je možný celý rad komplikácií: proliferatívna vitreoretinopatia (19 % prípadov), odlúčenie sietnice (12 – 23 %), tvorba makulárnej diery (9 %), ako aj komplikácie, ktoré sa vyskytujú pri vitrektómii z iných indikácií. . V tomto prípade môže dôjsť k strate nielen centrálneho, ale aj periférneho videnia. V súčasnosti táto technika nenašla široké uplatnenie.
O vyhliadkach na liečbu
Transplantácia pigmentového epitelu sietnice
V posledných rokoch sa uskutočnili pokusy uskutočniť transplantáciu RPE za experimentálnych podmienok ako alternatívnu alebo doplnkovú liečbu vekom podmienenej degenerácie makuly. Ak sa ešte pred 15 rokmi zdala transplantácia tkaniva sietnice nemožná, dnes sa úspešne vykonáva na zvieratách vo viacerých experimentálnych laboratóriách v rôznych krajinách.
Existujú aj skúsenosti s transplantáciou buniek RPE u viac ako 20 pacientov s AMD. Okrem toho bola vykonaná transplantácia retinálnych neurónových buniek u rovnakého počtu pacientov s retinitis pigmentosa.
Pri exsudatívnej forme VPMD sa po odstránení subretinálnych neovaskulárnych membrán používajú lokálne štepy (tzv. náplasti) a pri „suchej“ forme malé štepy (alebo Wok-plaky) a suspenzia RPE buniek.
Ukázalo sa, že doba prežitia ľudských aloimplantátov plodu v subretinálnom priestore závisí od veľkosti a charakteristík samotného štepu, jeho lokalizácie v sietnici a miestnych podmienok (stupeň exsudácie), za ktorých sa operácia vykonáva. Malé extrafoveálne štepy u neexsudatívnych foriem AMD prežívajú dlhý čas (roky). Väčšina ostatných transplantátov, najmä v dysciformnom štádiu, však neprežije, čo sa považuje za dôsledok ich odmietnutia telom.
Hlavným smerom budúceho výskumu v tejto oblasti je teda vývoj metód, ktoré zabraňujú odmietnutiu chlopne a imunologickej reakcii inkompatibility transplantovaného tkaniva. Podľa P. Gourasa a skupiny amerických výskumníkov z Kolumbijskej univerzity (1998) sú pre úspešnú transplantáciu nevyhnutné dve hlavné podmienky.
- Prvým je zlepšenie chirurgickej techniky s cieľom zabrániť alebo minimalizovať akúkoľvek zápalovú reakciu v mieste štepu, pretože zápal vyvoláva imunitné reakcie, a rozšírené používanie elektronicky riadených metód „mikroinjekcie“ na vytvorenie podmienok potrebných na odlúčenie sietnice neurónu. vezikula, do ktorej sa má vložiť štep. Veľký význam má aj kvalita štepu. N.S. Bhatt a spol. (1996) veria, že najjemnejším a najpresnejším prístupom k transplantácii je zavedenie fetálnych ľudských RPE buniek kultivovaných na kolagénovom substráte do subretinálneho priestoru. Podľa D. BenEzru (1996) na minimalizáciu zápalovej reakcie je výhodné použiť nie suspenziu buniek RPE, ale lokálnu vrstvu embryonálneho RPE. Okrem toho naznačuje, že klinické využitie epidermálneho rastového faktora má veľký potenciál vďaka jeho významnej a špecifickej aktivite ako stimulátora proliferácie buniek RPE. V tejto súvislosti L.V. Del Priore a kol. (1996) sa zameriavajú na cytokíny, ktoré môžu byť zodpovedné za autoreguláciu proliferácie pigmentových epitelových buniek.
Druhou podmienkou, ktorá rozhoduje o úspešnosti transplantačnej operácie, je podľa P. Gourasa (1998) vývoj metód, ktoré potláčajú odmietnutie transplantovaného tkaniva. Už sa pokúšajú systematizovať metódy imunosupresie používané pri liečbe AMD, ktoré sú v súčasnosti štandardné pri transplantácii orgánov: použitie cyklosporínu, azatioprínu a steroidov. Za týchto podmienok sa odolnosť RPE klapky proti odmietnutiu zvyšuje o viac ako 1 týždeň. Autori dospeli k záveru, že pri pokusoch na zvieratách je potrebné vyvinúť minimálne dávky potrebné na dosiahnutie adekvátnej imunosupresie, aby sa zabránilo odmietnutiu aloštepu RPE.
Vzhľadom na novosť metódy by sa všetky chirurgické zákroky vykonávané na ľuďoch mali považovať za experimentálne, preto by sa mala vyhodnotiť možnosť miernejšej imunosupresie u starších pacientov s AMD. Experimentálny model (králik) v súčasnosti študuje účinnosť kapsúl cyklosporínu-A s pomalým uvoľňovaním, ktoré po umiestnení do vitreálnej komôrky by mali spôsobiť skôr lokálnu než generalizovanú imunosupresiu. Problémom je zabezpečiť skutočne pomalé uvoľňovanie cyklosporínu-A, pretože zrýchlené uvoľňovanie kapsúl spôsobuje určité poškodenie fotoreceptorov, čo neprispieva k úspechu transplantácie.
Napriek rastúcim klinickým skúsenostiam s transplantáciami RP zostáva otázka, či aloštepy pigmentového epitelu skutočne môžu ovplyvniť priebeh makulárnej degenerácie súvisiacej s vekom, nejasná. Predpokladá sa, že možnosť chirurgickej liečby tohto ochorenia sa ukáže, ak sa dosiahne úspešná rekonštrukcia zdravej monovrstvy RPE (aspoň v oblasti aloštepu) cez všetky vrstvy v makule, čo si následne vyžaduje zlepšenie subfoveálneho chirurgického zákroku. technika.
Niet pochýb ani o tom, že pre zachovanie celistvosti buniek bude potrebné testovanie a úprava techniky ich „doručovania“. Stále nie je známe, či zdravá monovrstva umiestnená na povrchu atrofickej vrstvy RPE hostiteľa bude fungovať dobre ako úplná dvojvrstva alebo viacvrstva pigmentového epitelu. Ako ukázali štúdie na opiciach, viacvrstvová transplantovaná RPE ľudského plodu, t.j. xenoimplantát, môže podporovať niektoré z vonkajších segmentov tyčiniek a čapíkov po dobu najmenej 6 mesiacov.
V súčasnosti je jednou z perspektívnych metód liečby ťažkých foriem vekom podmienenej degenerácie makuly (VPDM) transplantácia pigmentového epitelu sietnice (RPE) vo forme bunkovej suspenzie alebo pigmentového komplexu choroidey (CHSK). Modernejším prístupom je vytvorenie 3D RPE sféroidov pre následnú subretinálnu transplantáciu. Sféroid je konglomerát buniek, ktoré sa zhromažďujú pod silou vlastnej gravitácie a sú spojené medzibunkovými spojeniami. 3D sféroidy majú priemer niekoľko stoviek mikrometrov (200-700), čo umožňuje ich vstreknutie pod sietnicu pomocou moderných mikroinvazívnych nástrojov, rýchlo sa usadia v kvapaline a po prichytení na rovný povrch prejavia efekt šírenie (šírenie) vrstvy buniek okolo seba. Transplantácia RPE vo forme 3D sféroidov si však vyžaduje predklinické štúdie. Králiky sú tradičným modelom oftalmologického výskumu.
Štandardné zloženie živného média (DMEM/F12, FBS, roztok L-glutamínu a antibiotika) je prijateľné na kultiváciu králičieho RPE. 3D RPE sféroidy dodávané subretinálne pomocou navrhovanej technológie vykazujú výrazné adhézne vlastnosti k cievnatke.
Genetické inžinierstvo
Nedávno sa uskutočnili štúdie o transdukcii kultivovaného ľudského fetálneho RPE retrovírusom (antivírusom), ktorý do týchto buniek vnáša dva gény: gén, ktorý produkuje zelený fluorescenčný proteín (GFP) a gén, ktorý produkuje endostatín alebo angiostatín (potenciálny antineovaskulárny faktory).
GFB je užitočný experimentálne, pretože umožňuje vidieť štepy v živej sietnici neinvazívnym spôsobom pri použití skenovacieho laserového oftalmoskopu (488 nm argónový laser cez fluorescenčný bariérový filter). Podobným spôsobom možno in vivo sledovať odmietnutie xenotransylantátu v sietnici a porovnať účinky kapsúl s pomalým uvoľňovaním cyklosporínu-A a placeba.
Gén pre endostatín je užitočný pri prevencii neovaskularizácie, ale v dôsledku existujúcej rejekčnej reakcie ho zatiaľ nemožno aktívne použiť ani pre alo- alebo xenoštepy. Existuje však nádej na vyriešenie tohto problému v blízkej budúcnosti.
Ďalšou stratégiou pri použití geneticky upravených buniek na boj proti neovaskularizácii, ktorá sa vyvíja na Kolumbijskej univerzite (USA), je pokus o transdukciu vírusu do pigmentového epitelu dúhovky pacienta získaného jednoduchou iridektómiou. Pigmentový epitel dúhovky sa môže kultivovať, transdukovať, potom môže nasledovať expresia génu in vitro a potom transplantovať do submakulárneho priestoru v tesnej blízkosti oblasti neovaskularizácie. Podľa P. Gourasa by takéto aloštepy mali prežívať neobmedzene dlho a lokálne uvoľňovať endostatín na potlačenie neovaskularizácie. Existujú aj kontrolné gény, ktorých pridanie do vírusového konštruktu umožní „zapnúť“ a „vypnúť“ expresiu endostatínu pomocou antibiotika.
Predpokladá sa, že takáto stratégia liečby neovaskularizácie je sľubná a sľubná. Jednou z jeho nevýhod je relatívne trvanie postupu na pestovanie a transdukciu dostatočného množstva pigmentového epitelu dúhovky in vitro (2-3 týždne), pričom vo väčšine prípadov si proces neovaskularizácie vyžaduje rýchly zásah. Na dočasné potlačenie neovaskularizácie v tomto časovom období sa však navrhuje použitie iných metód terapie, ako je fotodynamická terapia.
 Centrálna serózna chorioretinopatia (CSC) je serózne odlúčenie retinálneho neuroepitelu s alebo bez odlúčenia pigmentového epitelu v dôsledku zvýšenej permeability Bruchovej membrány a úniku tekutiny z choriokapilár cez pigmentový epitel sietnice (RPE). Na stanovenie diagnózy by sa mala vylúčiť taká patológia, ako je: choroidálna neovaskularizácia, prítomnosť zápalu alebo nádoru cievovky.
Centrálna serózna chorioretinopatia (CSC) je serózne odlúčenie retinálneho neuroepitelu s alebo bez odlúčenia pigmentového epitelu v dôsledku zvýšenej permeability Bruchovej membrány a úniku tekutiny z choriokapilár cez pigmentový epitel sietnice (RPE). Na stanovenie diagnózy by sa mala vylúčiť taká patológia, ako je: choroidálna neovaskularizácia, prítomnosť zápalu alebo nádoru cievovky.
CSC bola dlho považovaná za chorobu hlavne mladých mužov (25-45 rokov). V posledných rokoch sa v literatúre objavujú správy o zvyšovaní podielu žien a rozšírení vekového rozpätia nástupu ochorenia.
Klasický CSC je spôsobený jedným alebo viacerými únikmi RPE pozorovanými na fluoresceínovej angiografii (FA) ako veľké oblasti hyperfluorescencie. Teraz je však známe, že CSC môže byť spôsobené aj difúznym presakovaním tekutiny cez RPE, ktoré je charakterizované oddelením retinálneho neuroepitelu prekrývajúce oblasti atrofie RPE.
- V prípade akút spontánna absorpcia subretinálnej tekutiny nastáva v priebehu 1-6 mesiacov s obnovením normálnej alebo takmer normálnej zrakovej ostrosti.
- Subakútny priebeh u niektorých pacientov CSC trvá viac ako 6 mesiacov, ale spontánne ustúpi do 12 mesiacov.
- Ochorenie, ktoré trvá dlhšie ako 12 mesiacov, je chronický typ prúdy.
V modernej oftalmológii je centrálna serózna chorioretinopatia zvyčajne rozdelená do dvoch hlavných skupín: akútna (typická) a chronická (atypická).
- Akútna forma CSH sa spravidla vyvíja u mladých pacientov a má priaznivú prognózu, vyznačuje sa idiopatickým oddelením neuroepitelu spojeného s objavením sa "aktívneho filtračného bodu", ktorý spravidla zodpovedá defektu v PE sietnice. Za 3–6 mesiacov od nástupu ochorenia sa v 70–90 % prípadov uzavrú filtračné body, v 70–90 % sa vyskytuje resorpcia subretinálnej tekutiny a retinálna neuroepiteliálna adherencia. Na obnovenie zrakovej ostrosti a kvality môže byť potrebný dlhší čas.
- Chronická forma Ochorenie sa spravidla vyvíja u pacientov nad 45 rokov, častejšie sa vyskytuje obojstranná lézia, ktorá je založená na dekompenzácii PE buniek, sprevádzaná rozvojom ireverzibilných atrofických zmien v centrálnych častiach sietnice a zhoršením zrakové funkcie.
Etiopatogenéza
 Predchádzajúce hypotézy spájali vývoj ochorenia s poruchami normálneho transportu iónov cez RPE a fokálnou choroidálnou vaskulopatiou.
Predchádzajúce hypotézy spájali vývoj ochorenia s poruchami normálneho transportu iónov cez RPE a fokálnou choroidálnou vaskulopatiou.
Príchod indocyanínovej zelenej angiografie (ICGA) zdôraznil dôležitosť stavu choroidálnej cirkulácie v patogenéze CSC. ICA preukázala prítomnosť multifokálnej zvýšenej choroidálnej permeability a plošnej hypofluorescencie naznačujúcej fokálnu choroidálnu vaskulárnu dysfunkciu. Niektorí vedci sa domnievajú, že počiatočná choroidálna vaskulárna dysfunkcia následne vedie k sekundárnej dysfunkcii priľahlého RPE.
Klinické štúdie ukazujú prítomnosť serózneho odlúčenia sietnice a pigmentového epitelu a neprítomnosť krvi pod sietnicou. Pri odlúčení pigmentového epitelu možno pozorovať lokálnu stratu pigmentu a jeho atrofiu, fibrín a niekedy depozity lipofuscínu.
Konštitúcia a systémová hypertenzia môžu korelovať s CSH, pravdepodobne v dôsledku zvýšených hladín kortizolu a adrenalínu v krvi, ktoré ovplyvňujú autoreguláciu choroidálnej hemodynamiky. Okrem toho, Tewari a spol., zistili, že pacienti s CSC majú zníženú aktivitu parasympatiku a výrazné zvýšenie aktivity sympatiku v autonómnom nervovom systéme.
Multifokálna elektroretinografická štúdia preukázala bilaterálnu difúznu dysfunkciu sietnice, aj keď bola CSC aktívna iba v jednom oku. Tieto štúdie ukazujú prítomnosť systémových zmien, ktoré ich ovplyvňujú, a podporujú myšlienku difúzneho systémového účinku na vaskularizáciu cievovky.
CSC môže byť prejavom systémových zmien, ktoré sa vyskytujú pri transplantácii orgánov, podávaní exogénnych steroidov, endogénnom hyperkortizolizme (Cushingov syndróm), systémovej hypertenzii, systémovom lupus erythematosus, tehotenstve, gastroezofageálnom refluxe, užívaní Viagry (sildenafil citrát), ako aj užívanie psychofarmák, antibiotík a alkoholu.
Diagnostika
 Aj keď centrálna zraková ostrosť zostáva dobrá, mnohí pacienti pociťujú nepohodlie vo forme dyschromatopsie, zníženého vnímania kontrastu, metamorfopsie a oveľa menej často nyktalopie („nočná slepota“).
Aj keď centrálna zraková ostrosť zostáva dobrá, mnohí pacienti pociťujú nepohodlie vo forme dyschromatopsie, zníženého vnímania kontrastu, metamorfopsie a oveľa menej často nyktalopie („nočná slepota“).
K podozreniu na CSC dochádza pri monokulárnom rozmazanom videní, objavení sa metamorfopsie a dioptrického syndrómu (získaná hypermetropia). Zraková ostrosť po korekcii s pozitívnymi okuliarmi je zvyčajne 0,6-0,9.Aj pri absencii indikácií na prítomnosť metamorfopsie sa ľahko detegujú pri skúmaní Amslerovej mriežky.
Dôkladné vypočúvanie zvyčajne zistí, že pacient sa cíti viac-menej pohodlne až pri stredných úrovniach osvetlenia – ostré svetlo spôsobuje pocit slepoty a v šere vidí oveľa horšie, pretože sa mu pred očami objavuje priesvitná škvrna.Pri výrazne výraznej mikropsii vznikajú poruchy binokulárneho videnia, čo núti pacienta vyhýbať sa niektorým činnostiam (napríklad vedeniu auta). Často sa ukáže, že nejde o prvý prípad ochorenia a za podobných podmienok došlo k jeho recidíve. Niekedy si však chorý človek, naopak, chorobu nespája s nejakými vonkajšími okolnosťami.
V spodnej časti oka určuje sa bublina serózneho oddelenia neurosenzorickej sietnice, ktorá sa nachádza v makule, má jasné hranice a zvyčajne má zaoblený tvar. Jeho priemer je 1-3 priemery optického disku. Okrem odlúčenia neuroepitelu sa často zisťujú defekty v pigmentovej vrstve, depozity subretinálneho fibrínu a lipofuscínu. Subretinálna tekutina je priehľadná, neurosenzorická sietnica nie je zhrubnutá.Toto odlúčenie je oveľa ľahšie detekovateľné oftalmoskopiou s bezčerveným filtrom a jeho hranice sú zreteľnejšie viditeľné (niekedy doslova „blikajú“) pri oftalmoskopii s najviac aperturovaným zdrojom svetla. Táto žiara hraníc odlúčenia sa vysvetľuje skutočnosťou, že v malej hĺbke seróznej dutiny ňou prechádza svetlo, ako cez svetlovod, pričom sklovec opúšťa na hranici priľahlej sietnice.
Diagnóza potrieb CSC angiografické potvrdenie . Obzvlášť informatívne sú skoré a oneskorené obrázky. V typických prípadoch sa pozoruje skorý výskyt filtračného bodu. Klasickým popisom filtračného bodu je prítomnosť hyperfluorescenčného ohniska v oblasti serózneho oddelenia so stúpajúcim prúdom farbiva vo forme "stĺpca dymu" z neho. Medzitým je v praxi oveľa bežnejšia difúzia farbiva vo forme "atramentovej škvrny", ktorá sa šíri koncentricky z miesta filtrácie.
Počas štúdie sa fluoresceín distribuuje do celého močového mechúra. Oneskorené snímky ukazujú difúznu hyperfluorescenciu zóny oddelenia. Štúdia môže odhaliť zmeny v pigmentovom epiteli v susedstve, čo naznačuje predtým prenesené exacerbácie CSH, ktoré zostali nepovšimnuté. Filtračný bod sa najčastejšie nachádza v hornom nazálnom štvorci od stredu makuly. Litografické vyšetrenie fundusu indokyanínom u pacientov s CSC často odhalí oblasť počiatočnej hypofluorescencie o niečo väčšiu ako je priemer filtračného bodu. Táto počiatočná hypofluorescencia sa rýchlo mení na hyperfluorescenciu v strednej a neskorej fáze štúdie (medzi 1 a 10 minútami). Vysvetľuje sa to zvýšenou permeabilitou choriokapilár. Často existujú oblasti hyperfluorescencie, ktoré nie sú viditeľné na fluoresceínovej angiografii. Indokyanínová angiografia teda potvrdzuje difúznu povahu poškodenia cievnatiek pri centrálnej seróznej choriopatii.
Optická koherentná tomografia (OCT) vykazuje rôzne typy patofyziologických zmien v CSC, od objavenia sa subretinálnej tekutiny a odchlípenia pigmentového epitelu až po dystrofické zmeny na sietnici v chronickej forme priebehu ochorenia. OCT je obzvlášť užitočná pri identifikácii menších a dokonca subklinických odchlípení sietnice v makulárnej oblasti.
Odlišná diagnóza
- Exsudatívna forma AMD.
- Makulárny edém Irvine-Gass.
- Makulárna diera.
- subretinálna neovaskulárna membrána.
- Choroidálna neovaskularizácia.
- Choroidálny hemangióm
- Exsudatívne odlúčenie sietnice.
- Rhegmatogénne odlúčenie sietnice.
- Tuberkulózna choroiditída
- Choroba Vogt-Koyanagi-Harada.
Liečba
Vo väčšine prípadov sa CSC vyrieši sám bez akejkoľvek liečby (predpokladané zvládnutie v priebehu 1-2 mesiacov), lokálne serózne oddelenie zmizne bez stopy a zrak sa vráti na pôvodné hranice. Mnohí pacienti s primerane dobrým zrakom sa však stále sťažujú na skreslenie farieb alebo priesvitnú škvrnu pred postihnutým okom. Tieto sťažnosti je možné objektivizovať kontrolou zraku pomocou vízovo-kontrastometrické tabuľky, podľa ktorého na rozdiel od štandardných tabuliek na kontrolu zrakovej ostrosti je stále možné zistiť rozdiely vo vnímaní od normy, najmä v oblasti vysokých frekvencií vnímania. Práve u týchto jedincov nadobudne priebeh ochorenia chronický charakter alebo je charakterizovaný častými recidivami serózneho odchlípenia sietnice. Pacienti s klasickým CSCR majú riziko recidívy asi 40 – 50 % na tom istom oku.
Mnoho výskumníkov spochybňuje účinnosť liečby drogami, avšak vzhľadom na zvláštnosti patogenézy, konkrétne prítomnosť neurogénneho faktora, je stále vhodné predpisovať trankvilizéry.
laserové ošetrenie
Rozhodnutie o laserovej koagulácii sietnice by sa malo prijať v nasledujúcich prípadoch:
- prítomnosť serózneho odlúčenia sietnice počas 4 mesiacov alebo dlhšie;
- recidíva CSCR v oku s existujúcim znížením zrakovej ostrosti po predchádzajúcom CSCR;
- prítomnosť poklesu zrakových funkcií v druhom oku po CSCR v histórii;
- profesionálna alebo iná potreba pacienta vyžadujúca rýchlu obnovu zraku.
- Laserovú liečbu možno zvážiť aj u pacientov s opakujúcimi sa epizódami serózneho odlúčenia s bodom úniku fluoresceínu viac ako 300 µm od stredu fovey.
V prítomnosti jedného alebo viacerých bodov úniku farbiva, stanovených fluoresceínovou angiografiou, umiestnených ďaleko od foveolárnej avaskulárnej zóny (FAZ), je nadprahová koagulácia sietnice účinnou a relatívne bezpečnou metódou. Okrem toho sa vzdialenosť od avaskulárnej zóny podľa rôznych autorov pohybuje od 250 do 500 mikrónov. Na liečbu sa používa laserové žiarenie viditeľného rozsahu pri vlnovej dĺžke 0,532 mikrónu a blízkeho infračerveného rozsahu pri vlnovej dĺžke 0,810 mikrónu, pretože sú to ich spektrálne charakteristiky, ktoré poskytujú najšetrnejší účinok na tkanivá fundusu. Parametre žiarenia sa vyberajú individuálne, kým sa neobjaví koagulačné ohnisko typu 1 podľa klasifikácie L "Esperance. Pri použití žiarenia s vlnovou dĺžkou 0,532 μm sa výkon pohybuje od 0,07 do 0,16 W, trvanie expozície je 0,07-0,1 s , priemer bodu 100-200 mikrónov Pri použití žiarenia s vlnovou dĺžkou 0,810 mikrónov sa výkon pohybuje od 0,35 do 1,2 W, trvanie expozície je 0,2 s, priemer bodu je 125-200 mikrónov. výskumníci sa domnievajú, že riziko recidívy ochorenia je menšie u zrážaných očí ako u nezrážaných.
Napriek nespochybniteľnej účinnosti nadprahovej koagulácie filtračných bodov má metóda množstvo obmedzení, nežiaducich účinkov a komplikácií, akými sú atrofia pigmentového epitelu, tvorba subretinálnej neovaskulárnej membrány (SNM) a vznik absolútnych skotómov.
Rozšírenie možností v liečbe CSC je spojené s rozsiahlym využívaním režimov mikropulzného laserového žiarenia v klinickej praxi. Najsľubnejšie je navyše použitie diódového laserového žiarenia s vlnovou dĺžkou 0,81 μm, ktorého spektrálne charakteristiky zabezpečujú jeho selektívny účinok na mikroštruktúry chorioretinálneho komplexu.
V režime mikropulzov generujú lasery sériu („výbuchov“) opakujúcich sa nízkoenergetických impulzov ultrakrátkeho trvania, ktorých koagulačný efekt po súčte spôsobuje zvýšenie teploty len v cieľovom tkanive, t.j. v pigmentovom epiteli. Vďaka tomu sa v susedných štruktúrach nedosahuje koagulačný prah, pretože majú čas na vychladnutie, čo umožňuje vo väčšej miere minimalizovať škodlivý účinok na neurosenzorické bunky.
V prítomnosti bodov úniku lokalizovaných sub- alebo juxtafoveolárne a najmä na pozadí atrofických zmien v PE teda väčšina výskumníkov používa podprahovú mikropulznú laserovú koaguláciu sietnice (SMILK) pomocou diódového laserového žiarenia s vlnovou dĺžkou 0,81 μm. Po laserových intervenciách bola zaznamenaná absencia komplikácií charakteristických pre nadprahovú koaguláciu.
Existujú rôzne modifikácie SMILK. V posledných rokoch sa fotodynamická terapia (PDT) s vizdinom stala alternatívnou liečbou chronickej formy CSC. Táto technika, zameraná na uzavretie filtračného bodu v dôsledku defektu PE, môže urýchliť elimináciu exsudácie v dôsledku choriokapilárnej oklúzie a zastaviť únik v tejto zóne. Po PDT dochádza k rekonštrukcii cievnatiek a znižuje sa ich priepustnosť. Pozitívny účinok PDT pri liečbe tohto ochorenia bol dosiahnutý mnohými výskumníkmi. Podľa rôznych autorov k regresii retinálneho neuroepiteliálneho odlúčenia (ONE) dochádza približne u 85-90 % pacientov, pričom si zachováva vysokú zrakovú ostrosť v priemere 0,6-0,7. Pri liečbe chronickej CSH je vhodné užívať liek v polovičnej štandardnej dávke, pretože. tým sa zabráni možným komplikáciám (výskyt sťažností pacientov na zväčšenie škvrny pred okom, angiogramy v postihnutých oblastiach odhalili nové zóny atrofie PE) s rovnakou úrovňou účinnosti, aká sa dosiahne pri použití plnej dávky.
V literatúre je málo správ o použití transpupilárnej terapie pri liečbe chronického CSH. Autori zaznamenali štatisticky významné (s<0,001) уменьшение ОНЭ и стабилизацию зрительных функций.
Pokiaľ ide o intravitreálne podávanie inhibítorov endotelového vaskulárneho rastového faktora (lucentis, avastin) v liečbe CSC, v súčasnosti neexistuje jednoznačný názor. V klinickej praxi sa inhibítory angiogenézy ukázali nielen ako činidlá, ktoré inhibujú rast novotvarov, ale preukázali aj výrazný protiedematózny účinok. Sú opísané prípady úspešného použitia Avastinu pri akútnej aj chronickej forme ochorenia.
Liečba akútnej formy CSC teda doteraz nespôsobuje ťažkosti. Ak nenastane samoobnovenie, použije sa tradičná laserová koagulácia sietnice alebo mikropulz v závislosti od umiestnenia filtračných bodov. V liečbe chronickej formy CSH je viacero smerov: skúma sa mikropulzná laserová koagulácia, perspektívy využitia fotodynamickej terapie, transpupilárna terapia a inhibítory angiogenézy.
20.04.2018
![]()
Odštiepenie rohovky. Tieto slová počul každý človek počas svojho života v tom či onom kontexte a sú vždy sprevádzané úzkosťou a strachom. Ako stav sa odlúčenie sietnice skutočne týka ohrozenia, ak nie života, tak zraku. Oneskorenie liečby, predčasný prístup k lekárovi, diagnostické chyby a iné prekážky na ceste k zbaveniu sa tohto stavu hrozia nezvratnou stratou zraku.
Čo je sietnica a prečo je dôležitá?
Predstavte si oko v sagitálnom, teda šípkovom reze. Povrch oka je pokrytý priehľadnou membránou nazývanou spojovka. Nad zrenicou prechádza spojovka do rohovky. Pod spojovkou je skléra - je biela a pod rohovkou je dúhovka, v strede ktorej je zrenička. Za zrenicou je šošovka a za ňou je sklovec.

Vypĺňa väčšinu vnútroočného priestoru a medzi ním a sklérou je sietnica, čiže sietnica. Jeho funkciou je vnímanie svetelných lúčov zhromaždených a lámaných rohovkou a šošovkou. Inými slovami, táto štruktúra zrakového orgánu je zodpovedná za koordinovanú prácu vizuálneho analyzátora, ktorý premieňa prijaté svetelné impulzy na elektrické, ktoré sa následne prenášajú do kortikálneho analyzátora pozdĺž zrakového nervu.
 Sietnica pozostáva z nerovnomerne rozdeleného počtu dvoch typov nervových buniek – tyčiniek a čapíkov. Prvé sú zodpovedné za vnímanie svetla, schopnosť rozlíšiť obrysy predmetov v tme a tiež navigáciu vo vesmíre. Sú umiestnené pomerne rovnomerne po celom povrchu sietnice, no stále na periférii je ich počet väčší. Šišky sú zodpovedné za rozdiel vo farbách, ich odtieňoch a zrakovej ostrosti vo všeobecnosti. Tento typ nervových buniek je zameraný v centrálnej časti sietnice, pretože práve na túto oblasť sa premietajú lomené lúče svetla.
Sietnica pozostáva z nerovnomerne rozdeleného počtu dvoch typov nervových buniek – tyčiniek a čapíkov. Prvé sú zodpovedné za vnímanie svetla, schopnosť rozlíšiť obrysy predmetov v tme a tiež navigáciu vo vesmíre. Sú umiestnené pomerne rovnomerne po celom povrchu sietnice, no stále na periférii je ich počet väčší. Šišky sú zodpovedné za rozdiel vo farbách, ich odtieňoch a zrakovej ostrosti vo všeobecnosti. Tento typ nervových buniek je zameraný v centrálnej časti sietnice, pretože práve na túto oblasť sa premietajú lomené lúče svetla.
Medzi bielkom a sietnicou je tenká cievnatka, ktorá zabezpečuje výživu periférnej časti vizuálneho analyzátora. Oddelenie sietnice od cievovky oka má za následok porušenie jej trofizmu, čo znamená nekrózu a stratu schopnosti transformovať a prenášať ďalšie svetelné impulzy. Inými slovami, človek jednoducho stratí zrak.
Príčiny odlúčenia sietnice
Dôvody vývoja takého závažného patologického procesu sú zvyčajne rozdelené do skupín, a preto existuje niekoľko etiologických typov odlúčenia sietnice.
- Trakcia, ktorej veľká väčšina prípadov je spojená s patológiou sklovca. Sklovité telo, ktoré je tesne priľahlé k sietnici, môže vytvárať napätie v niektorých svojich oblastiach počas tvorby vlákien spojivového tkaniva alebo klíčenia krvných ciev. K podobným zmenám na sklovci dochádza najmä pri diabetickej retinopatii, a preto by diabetici mali pravidelne preventívne navštevovať očného lekára.
- Pri regmatogénnom odlúčení sietnice dochádza k jej pretrhnutiu v mieste, kde sa premieňa alebo stenčuje jej normálna štruktúra. Transformácia miest sa často vyskytuje v dôsledku dystrofických zmien, ktoré nemusia byť diagnostikované, kým sa neobjaví prasknutie. Človek jednoducho začne cítiť symptómy, ktoré sprevádzajú túto patológiu, bez najmenšieho podozrenia na ich povahu. Z tohto dôvodu sa regmatogénne odlúčenie nazýva aj primárne alebo idiopatické, teda také, ktorého príčinu nemožno presne určiť. Tekutina produkovaná sklovcom spadá pod oblasť oddelenia a v dôsledku porušenia trofických procesov sietnica na tomto mieste odumiera a vízia pacienta s ňou "umiera". Medzera na dystroficky zmenených miestach sa môže vyskytnúť pri nadmernej fyzickej námahe, pri pokuse o zdvíhanie závažia, pri náhlych pohyboch alebo dokonca v pokoji.
- Sekundárne odlúčenie sietnice, ku ktorému dochádza na základe existujúcich ochorení funkčných štruktúr oka. Patria sem infekčné a zápalové ochorenia oka, novotvary, trombóza, retinopatia a krvácanie.
- Traumatické odlúčenie sietnice. Tento typ patológie je vyvolaný traumou a následné odlúčenie môže nastať tak v čase jeho prijatia, ako aj v priebehu hodín / mesiacov / rokov po pôsobení traumatického faktora. Do tejto kategórie patria aj oddelenia, ktoré vznikli na pozadí chirurgickej intervencie.
- Serózne (exsudatívne) odlúčenie sietnice, ku ktorému dochádza v procese akumulácie tekutiny za sietnicou. Samotná sietnica nepodlieha prasknutiu ani dystrofickým zmenám.

Nie je možné s istotou povedať o vzťahu medzi oddelením sietnice a nasledujúcimi faktormi, bolo však zaznamenané, že často sprevádzajú vzniknutú patológiu. Tie obsahujú:
- Starší vek. Ľudia starší ako šesťdesiat rokov majú v porovnaní s mladšími ľuďmi zvýšené riziko vzniku tohto ochorenia.
- Mopia vysokého stupňa. Až polovicu prípadov odlúčenia sietnice vo svete sprevádza prítomnosť vysokých stupňov krátkozrakosti.
- Odložené operácie na očiach. Štatistiky ukazujú štyridsať percent prípadov patológie v reakcii na operáciu očí.
- Prítomnosť hypertenzie a najmä hypertenzných kríz.
Tieto rizikové faktory by mali upozorniť svojich majiteľov na výskyt takejto závažnej patológie a naliehať na pacientov, aby starostlivo sledovali svoje zdravie, aby nezmeškali počiatočné príznaky odlúčenia sietnice.
Známky odlúčenia sietnice
 Odlúčenie sietnice zaväzuje každého poznať jeho príznaky, a nielen tých, ktorí sú jeho výskytom najviac ohrození. Tak si ich pripomeňme.
Odlúčenie sietnice zaväzuje každého poznať jeho príznaky, a nielen tých, ktorí sú jeho výskytom najviac ohrození. Tak si ich pripomeňme.
- Pred očami sa mihajú čierne bodky, ktoré narúšajú sústredenie sa na predmet, nezmiznú po odpočinku alebo spánku.
- Na samom začiatku odlúčenia môže pacient venovať pozornosť výskytu zábleskov v očiach, ktoré sa javia ako svetelné oslnenie, blesky, svetelné škvrny.
- Aj v tomto štádiu pacienti zaznamenávajú zakrivenie priamych čiar, osciláciu predmetných predmetov, ich chvenie a rozmazanie.
- Objavuje sa progresívny pokles zrakovej ostrosti, ktorého časový rámec je veľmi úzky: pri masívnom oddelení môže človek stratiť zrak už za niekoľko hodín.
- Objaví sa čierna škvrna, závoj alebo čiara. Táto temnota je oblasťou odlúčenia, ktorá už nevníma a neprenáša svetelné impulzy ďalej na spracovanie do centrálneho orgánu nervového systému - mozgu. Lokalizácia slepej oblasti v zornom poli je určená lokalizáciou oblasti odlúčenia sietnice. Tento príznak prechádza do úplnej straty zraku, keď pacient mešká.
Dôležité! Keď sa pri vymenovaní lekára objaví tmavý závoj, je potrebné objasniť, z ktorej strany sa začal šíriť.
- Odlúčenie sietnice, ktorého príznakom je zúženie zorného poľa, sa nazýva okrajové alebo periférne. V takejto situácii sa vízia začína vytrácať „z okrajov“. Po spánku a ráno je tento príznak o niečo znížený, čo pacient mylne berie na zlepšenie klinického stavu.
- Príznakom odlúčenia sietnice je v niektorých prípadoch strata písmen, slov alebo častí textu zo zorného poľa pri čítaní. To naznačuje zachytenie centrálnej časti sietnice patologickým procesom.
Zákernosť tejto patológie spočíva v tom, že napriek všetkej jej závažnosti nespôsobuje bolesť. S takýmto priebehom ochorenia sa človek nemusí ponáhľať k lekárovi, "pretože to nebolí", odpísanie výskytu odlúčenia sietnice a jej symptómov na prepracovanie, nervové šoky a iné životné okolnosti. Namiesto toho, aby okamžite išli k očnému lekárovi, takíto pacienti trávia vzácne hodiny spánkom a odpočinkom, pretože veria, že ráno všetko zmizne samo.
A ak sa ráno po dlhom pobyte v horizontálnej polohe sietnica „dostane“ na miesto, tesnejšie priľne k cievnatke a príznaky ochorenia sa znížia, človek môže úplne odmietnuť návštevu lekára s odkazom na pozitívna dynamika.

Jedinou účinnou metódou liečby je chirurgický zákrok a čím skôr sa vykoná, tým väčšie sú šance pacienta v nádeji, že sa mu vráti plné videnie.
Diagnóza odlúčenia pigmentového epitelu sietnice
Napriek tomu, že odlúčenie sietnice so svojimi príznakmi je v očnej praxi núdzovým stavom, pred začatím liečby tohto stavu je potrebné vykonať komplexné lekárske vyšetrenie pacienta.
- Vyšetrenie oftalmoskopom vám umožní posúdiť lokalizáciu, tvar a veľkosť patologického procesu. Prítomnosť sietnicových slz je potvrdená alebo vyvrátená.
- Vykonajte výskum pomocou kontaktných a bezkontaktných šošoviek.
- Pri chronickom odlúčení sietnice sa používajú elektrofyziologické výskumné metódy na posúdenie funkčnosti oka a zároveň na prognózu obnovy zraku u pacienta.
- Ak existujú sprievodné ochorenia oka, ktoré sťažujú štúdium šošovkami alebo oftalmoskopom, používa sa ultrazvuk.
- Vykonáva sa perimetria a hodnotí sa zraková ostrosť, čo náležitým spôsobom prispieva k určeniu veľkosti a lokalizácie patologického procesu.
- Dodatočne sa meria vnútroočný tlak, ktorý môže byť v porovnaní so zdravým okom znížený.
Odlúčenie sietnice: príznaky v oftalmoskope
 Normálne vyšetrenie očného pozadia oftalmoskopom s použitím plusových šošoviek dáva červený reflex. Toto je názov odrazu svetla od vnútorného povrchu oka a je skutočne červený. Táto farba je spôsobená presvitaním krvných ciev cez sietnicu, ktorá, ako už bolo spomenuté vyššie, slúži ako zdroj silného prekrvenia a výživy sietnice.
Normálne vyšetrenie očného pozadia oftalmoskopom s použitím plusových šošoviek dáva červený reflex. Toto je názov odrazu svetla od vnútorného povrchu oka a je skutočne červený. Táto farba je spôsobená presvitaním krvných ciev cez sietnicu, ktorá, ako už bolo spomenuté vyššie, slúži ako zdroj silného prekrvenia a výživy sietnice.
S jeho oddelením červený reflex z fundusu zmizne a zanechá za sebou sivú alebo belavú farbu. Toto je obrázok s masívnym alebo úplným oddelením. Oddelenie malej výšky sa prejavuje len zmenou prehľadnosti prezeraných ciev, ich priebehu alebo veľkosti. Skúsený oftalmológ si však takéto drobné zmeny všimne.
Vysoké oddelenie pigmentovej vrstvy sietnice je definované ako vysoká bublina naplnená sivastou alebo bielou zakalenou tekutinou, ktorá môže kolísať s pohybom oka. Chronická exfoliácia zanecháva drsné oblasti sietnice, ktoré podliehajú vráskam, tvorbe záhybov a jaziev.
Pomocou oftalmoskopu môže lekár určiť aj prítomnosť medzery. Medzera vyzerá ešte viac červená na všeobecnom pozadí fundusu kvôli lepšej viditeľnosti cievovky. Ak bol patologický proces diagnostikovaný v štádiu, keď ďalšia liečba prinesie pozitívne výsledky, lekár môže na základe jednej oftalmoskopie urobiť predpoveď týkajúcu sa vyhliadok na liečbu a progresiu ochorenia.
![]()
Oddelenie sietnice: je možné vrátiť videnie?
Na túto otázku neexistuje jediná odpoveď. Ak chcete zistiť prognózy výsledkov liečby v každom konkrétnom prípade, je potrebné osobne navštíviť lekára. Pamätajte: čím skôr sa o liečbe poradíte s lekárom, tým viac výsledkov prinesie.
Existuje len jedna metóda liečby odlúčenia sietnice, a to chirurgická. Existujú však už dva jeho typy a delia sa na extrasklerálne, teda tie, ktoré sú produkované cez skléru, a endovitreálne, kde ako miesto prístupu do chorej oblasti pôsobí sklovec.
Princípom oboch typov operácií je zablokovanie medzery, ako aj priblíženie sietnice k cievovke. Obe slúžia na obnovenie adekvátneho trofizmu sietnice, ktorý je kľúčom k návratu a zachovaniu zraku.
Samozrejme, takýto hrozivý problém by sa mal riešiť v zdravotníckych zariadeniach, ktoré majú dostatočnú úroveň kvalifikácie a dokonalú povesť. Bezpochyby sa každý chce stretnúť s najpriateľskejším prístupom, pozornou pozornosťou a primeranými nákladmi na služby.
V Moskve multidisciplinárne lekárske centrum pomenované po Svyatoslavovi Fedorovovi plne spĺňa tieto požiadavky. Lekári, ktorí si neustále zvyšujú svoju kvalifikáciu, európske štandardy liečby a pozorný ošetrujúci personál sú to, čo vás čaká, keď sa obrátite na naše zdravotné stredisko.
Pamätajte, že oddelenie sietnice netoleruje diagnostické ani terapeutické chyby. Zachráňte s nami svoju víziu!
Náklady na operáciu odlúčenia sietnice:
| № | Názov služby | Cena v rubľoch | Vymenovanie |
|---|---|---|---|
| 2011074 | Zavedenie liekov 3. stupňa zložitosti do dutiny sklovca | 65 000 | Prihlásiť Se |
| 2011073 | Zavedenie liekov 2. stupňa zložitosti do sklovcovej dutiny | 22 500 | Prihlásiť Se |
| 2011072 | Zavedenie liekov 1. stupňa zložitosti do sklovcovej dutiny | 18 500 | Prihlásiť Se |
| 2011071 | Periférna vitrektómia 3. kategórie zložitosti | 12 000 | Prihlásiť Se |
| 2011070 | Periférna vitrektómia 2. kategórie zložitosti | 10 000 | Prihlásiť Se |
| 2011069 | Periférna vitrektómia I. kategórie zložitosti | 8 000 | Prihlásiť Se |
| 2011068 | Mikroinvazívna revízia prednej komory | 12 000 | Prihlásiť Se |
| 2011075 | Intraoperačné podanie | 6 000 | Prihlásiť Se |
| 2011066 | Obnova prednej komory | 6 000 | Prihlásiť Se |
| 2011065 | Odstránenie perfluórorganických tekutín z dutiny sklovca | 7 500 | Prihlásiť Se |
| 2011064 | Odstránenie tekutého silikónu z dutiny sklovca | 10 000 | Prihlásiť Se |
| 2011063 | Cirkulárna retinotómia alebo retinektómia | 14 000 | Prihlásiť Se |
| 2011062 | Retinotómia a retinektómia | 7 500 | Prihlásiť Se |
| 2011061 | Zavedenie plynu do sklovcovej dutiny | 10 000 | Prihlásiť Se |
| 2011060 | Zavedenie tekutého silikónu do sklovcovej dutiny | 15 000 | Prihlásiť Se |
| 2011059 | Zavedenie perfluórorganických kvapalín do sklovcovej dutiny | 12 500 | Prihlásiť Se |
| 2011058 | Endolaserová koagulácia cirkulárnej periférnej sietnice | 13 750 | Prihlásiť Se |
| 2011057 | Endolaserová koagulácia sietnice, reštriktívna (jeden kvadrant) | 6 000 | Prihlásiť Se |
| 2011056 | Endodiatermokoagulácia | 7 500 | Prihlásiť Se |
| 2011055 | Odstránenie epiretinálnych membrán alebo zadnej hyaloidnej membrány tretej kategórie zložitosti | 48 000 | Prihlásiť Se |
| 2011054 | Odstránenie epiretinálnych membrán alebo zadnej hyaloidnej membrány druhej kategórie zložitosti | 39 750 | Prihlásiť Se |
| 2011053 | Odstránenie epiretinálnych membrán alebo zadnej hyaloidnej membrány prvej kategórie zložitosti | 30 500 | Prihlásiť Se |
| 2011067 | Endodrening subretinálnej tekutiny | 6 000 |
5772 0
Fibrovaskulárne odlúčenie pigmentového epitelu je jednou z foriem latentnej CNV. Čisto serózna sa prejavuje vezikulárnou eleváciou pigmentového epitelu v dôsledku nahromadenia tekutiny pod PE. Počas biomikroskopie fundusu lúč štrbinovej lampy zvýrazní oranžový krúžok.
Serózne odlúčenie pigmentového epitelu je tiež často sprevádzané seróznym odlúčením neuroepitelu v makulárnej oblasti. Pri fluoresceínovej angiografii sa stanoví rovnomerná rýchla akumulácia fluoresceínového farbiva v rámci odlúčenia pigmentového epitelu (obr. 1-18).
Ryža. 1-18. Oddelenie pigmentového epitelu sietnice.
A. Farebná fotografia fundusu. Oddelenie pigmentového epitelu sietnice s nahromadenou submakulárnou tekutinou, ktorá sa nachádza na temporálnej strane fovey. Z časového
strane oddelenia sú drúzy.
B. Stredná fáza fluoresceínového angiogramu. Hyperfluorescencia bola zaznamenaná zodpovedajúca oblasti masívneho odlúčenia retinálneho pigmentového epitelu.
B. Fáza recirkulácie na fluoresceínovom angiograme. Môžete vidieť nahromadenie farbiva pod
odlúčenie pigmentového epitelu a fibrovaskulárnej zložky odchlípenia v oblasti centrálnej jamky.
D. V neskorej fáze je viditeľný stupeň šírenia serózneho a fibrovaskulárneho odlúčenia pigmentového epitelu sietnice. Postihnutá oblasť zostáva nezmenená v porovnaní s fázou recirkulácie.

Ryža. 1-19. Serózne oddelenie pigmentového epitelu sietnice.
A. Farebná fotografia fundusu. Viditeľný je vezikulárny výbežok serózneho odlúčenia pigmentového epitelu (zväčšený obrázok).
B. Fluorescenčný angiogram. Existuje serózne oddelenie pigmentového epitelu lokalizovaného v oblasti fovey a "zúbkované" na nazálnej strane, čo naznačuje prítomnosť choroidálnej neovaskularizácie.
B. Fundus fluoresceínový angiogram iného pacienta s oddelením pigmentového epitelu bez „zubatého“.
D. Angiogram s indocyanínovou zelenou. V odlúčení pigmentového epitelu je lokálna oblasť hyperfluorescencie (šípka), čo je v súlade s podozrením na choroidálnu neovaskularizáciu.
Odlúčenie fibrovaskulárneho pigmentového epitelu môže byť kombinované so seróznym oddelením a na fluoresceínovom angiograme sa často javí ako „zubaté“ (obrázok 1-19 A, B); toto "zubaté" predstavuje CNV. Pri fibrovaskulárnych odlúčeniach pigmentového epitelu do tekutiny pod PE má často serózno-hemoragický charakter. Na detekciu CNV v prípade odlúčenia pigmentového epitelu sa odporúča angiografia s indocyanínovou zelenou (obr. 1-19, C, D).
S.E. Avetišová, V.K. Pečatný vosk
Táto patológia je chronický dystrofický proces s prevládajúcou léziou choriokapilárnej vrstvy Bruchovej membrány a pigmentového epitelu. Involučná centrálna chorioretinálna dystrofia (CHRD) je podľa štatistík hlavnou príčinou straty centrálneho videnia v druhej polovici života v populácii rozvinutých krajín. Závažnosť ochorenia je spôsobená centrálnou lokalizáciou procesu a spravidla bilaterálnymi léziami.
Etiológia
V etiológii involučnej CHRD je veľa nejasných bodov. Podľa najnovších údajov sa choroba považuje za geneticky podmienenú s autozomálne dominantným spôsobom dedičnosti.
Patogenéza
Začiatkom dystrofického procesu je objavenie sa drúz v centrálnych a paracentrálnych zónach sietnice. Drúzy sú nahromadením koloidnej látky medzi Bruchovou membránou a pigmentovým epitelom. Drúzy môžu byť tvrdé a mäkké. Prvé zanechávajú zóny atrofie pigmentového epitelu a choriokapilárnej vrstvy. Ten môže viesť k exsudatívnemu oddeleniu pigmentového epitelu a následne neuroepitelu (obr. 6-1,6-2).
Ďalší vývoj procesu je sprevádzaný objavením sa subretinálnej neovaskularizácie a prechodom ochorenia do exsudatívne-hemoragického štádia. Následne je možná resorpcia krvácaní a rozvoj vláknitého jazvového tkaniva.
Diagnostika
Vo väčšine prípadov nie je diagnostika náročná a je založená na oftalmoskopii a údajoch FAGD.
Ryža. 6-1. Oddelenie pigmentového epitelu (schematicky). PE - písomný epitel; MB, Bruchova membrána; EOPE - exsudatívne odlúčenie pigmentového epitelu; HC - choriokapiláry.

Ryža. 6-2. Oddelenie pigmentového epitelu so seróznym oddelením neuroepitelu. PE, pigmentový epitel; MB, Bruchova membrána; EONE - exsudatívne oddelenie neuroepitelu; EOPE - exsudatívne odlúčenie pigmentového epitelu; HC - choriokapiláry.
klasifikácia CRDC
Klasifikácia je založená najmä na štádiách vývoja dystrofického procesu. Existujú 3 formy ochorenia.
I. Neexsudatívna forma: drúzy sietnice, defekty pigmentového epitelu, redistribúcia pigmentu, atrofia pigmentového epitelu a choriokapilárnej vrstvy.
II. Exsudatívna forma:
- štádium exsudatívneho odlúčenia pigmentového epitelu;
- štádium exsudatívneho oddelenia neuroepitelu;
- neovaskulárne štádium;
- štádium exsudatívno-hemoragického odlúčenia pigmentového epitelu a neuroepitelu.
III. Zjazvená forma.
Poliklinika
Drúzy oftalmoskopicky sú zaoblené alebo oválne svetložlté subpigmentované ohniská. Ich veľkosti sú rôzne, môžu byť bodkované alebo splývajúce, s neostrými hranicami. Drúzy nespôsobujú pokles zrakových funkcií (obr. 6-3, 6-4, 6-5, 6-6, 6-7, 6-8).
Na fluorescenčných angiogramoch začnú drúzy fluoreskovať v skorých fázach s vyblednutím fluorescencie v neskorej venóznej fáze (obr. 6-9, 6-10, 6-11, 6-12).
Klinickými prejavmi neexsudatívnej formy CCRD sa najčastejšie stáva atrofia choriokapilárnej vrstvy a pigmentového epitelu (obr. 6-13, 6-14).
Pri exsudatívnom oddelení pigmentového epitelu je ohnisko okrúhle alebo oválne, s jasnými hranicami, lepšie sa určuje oftalmoskopiou v odrazenom svetle. Vizuálne funkcie sú mierne obmedzené.
Na fluoresceínovom angiograme je serózna tekutina v oblasti odlúčenia pigmentového epitelu včas zafarbená kontrastom, čo spôsobuje ohnisko hyperfluorescencie s jasnými hranicami (obr. 6-15, 6-16).
Exsudatívne oddelenie neuroepitelu nemá jasné hranice, vyskytuje sa v dôsledku porušenia bariérovej funkcie a deštrukcie spojenia buniek pigmentového epitelu. Dochádza k výraznému poklesu zrakových funkcií. Na fluoresceínovom angiograme je na rozdiel od obrázku s odlúčením pigmentového epitelu pomalé farbenie transudátu bez jasných hraníc (obr. 6-17, 6-18, 6-19).
Vývoj subretinálnej neovaskulárnej membrány skrytej pod exsudátom nie je vždy možné diagnostikovať. Existuje však množstvo oftalmoskopických nálezov naznačujúcich neovaskularizáciu. Medzi nimi zmena farby oddelenia neuroepitelu (špinavý sivý alebo mierne nazelenalý odtieň), výskyt perifokálnych krvácaní a ukladanie tuhého exsudátu. FAHD hrá dôležitú úlohu v diagnostike subretinálnej neovaskularizácie. Subretinálna neovaskulárna membrána je v skorých fázach definovaná ako čipka alebo koleso bicykla. V neskorých fázach je zaznamenaná dlhodobá svetlá extravazálna hyperfluorescencia v oblasti neovaskularizácie (obr. 6-20, 6-21). Ruptúra novovytvorených ciev vedie k subpigmentovým alebo subretinálnym krvácaniam (obr. 6-22, 6-23, 6-24, 6-25, 6-26). V zriedkavých prípadoch je možný prienik krvácania do sklovca s rozvojom hemoftalmie. Jazvovitá forma je charakterizovaná vývojom fibrózneho tkaniva s tvorbou jazvy (obr. 6-27).
Liečba
V neexsudatívnej forme sú predpísané antiagreganciá a vazodilatanciá, indikovaná je stimulácia sietnice nízkoenergetickým laserovým žiarením. Pri exsudatívnej forme sa používa dehydratačná terapia (lokálna a všeobecná) a laserová koagulácia sietnice v centrálnej zóne. Pri neovaskularizácii sa robí priama laserová koagulácia subretinálnej neovaskulárnej membrány.
Chirurgické metódy liečby sú zamerané najmä na zlepšenie prekrvenia zadného pólu oka a zahŕňajú rôzne druhy revaskularizačných a vazorekonštrukčných operácií.
Literatúra
- Katsnelson L.A., Forofonova T.I., Bunin A.Ya. Cievne ochorenia oka. - M.: Medicína, 1990. - S. 176-182.
- Gass J.D. Senilná disciformná makulárna degenerácia // Amer. J. Ophthalmol. - 1967. - Sv. 63, č. 3. - R. 617-629.
- Gass J.D. Stereoskopický atlas makulárnych chorôb. — sv. Louis atď.: CV Mosby Co., 1977.-411r.
- Schats H., Burton T., Lawrence A., Maurice F. Interpretácia fundus fluoresceínovej angiografie. — sv. Louis, 1978.
 | |
 | |
 | Konfluentné drúzy v makulárnej a centrálnej oblasti fundusu |
 | Konfluentné drúzy v centrálnej a paracentrálnej oblasti |
 | |
 | |
 | Druzy. FAGD. neskorá fáza. Fluorescencia pevných drúz v centrálnej zóne fundusu. |
 | Druzy. FAGD. arteriovenózna fáza. Fluorescencia viacerých pevných drúz. |
 | Druzy. FAGD. neskorá fáza. Fluorescencia konfluentných drúz v centrálnej zóne fundusu. |
 | Druzy. FAGD. neskorá fáza. Hyperfluorescencia viacerých drúz; hyperfluorescencia subretinálnej neovaskulárnej membrány v makulárnej oblasti s perifokálnou hypofluorescenciou sietnice, respektíve v oblasti krvácania. |
 | |
 | FAGD. neskorá fáza. Neexsudatívne CCRD, zóny hypo- a hyperfluorescencie sú spôsobené redistribúciou pigmentu. |
 | Oddelenie pigmentového epitelu. Ohnisko je zaoblené s jasnými hranicami v centrálnej zóne sietnice. |
 | FAGD. arteriovenózna fáza. Oddelenie pigmentového epitelu na pozadí drúz. Hyperfluorescencia odlúčenia pigmentového epitelu. |
 | |
 | FAGD. neskorá fáza. Hyperfluorescencia exsudatívneho oddelenia neuroepitelu. |
 | |
 | FAHD venózna fáza. Cikatrická forma CCRD so zónou hyperfluorescencie v oblasti subretinálnej neovaskulárnej membrány. |
 | |
 | FAHD neskorá fáza. Extravazálna hyperfluorescencia v oblasti subretinálnej neovaskulárnej membrány a hypofluorescencia v oblasti hemorágií. |
 | Exsudatívne-hemoragické štádium CCRD. Hyperfluorescencia odlúčenia neuroepitelu s hypofluorescenciou v oblasti krvácania. FAGD. arteriovenózna fáza. |
 | Hemoragické oddelenie pigmentového epitelu u pacienta s CCRD. |
 | Hemoragické oddelenie pigmentového epitelu. FAGD. arteriovenózna fáza. Hypofluorescencia v dôsledku skríningového účinku subretinálneho krvácania. |
 | |
 | Exsudatívne-hemoragické štádium dysciformného CCRD (pseudotumorózne). |
 | |
 | |
 | FAGD arterio-venózna fáza. Hyperfluorescencia v zóne odlúčenia pigmentového epitelu. |