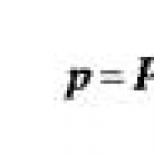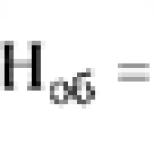Nasledujúce látky sú potrebné na realizáciu zrážania krvi. Zrážanie krvi (hemostáza). Prečo sa krv zráža
Zrážanie krvi by malo byť normálne, takže hemostáza je založená na rovnovážnych procesoch. Nie je možné, aby sa naša cenná biologická tekutina zrazila - to hrozí vážnymi smrteľnými komplikáciami (). Naopak, môže vyústiť do nekontrolovaného masívneho krvácania, ktoré môže viesť aj k smrti človeka.
Najzložitejšie mechanizmy a reakcie, na ktorých sa podieľa množstvo látok v tej či onej fáze, udržujú túto rovnováhu a umožňujú tak telu pomerne rýchlo si poradiť samo (bez pričinenia akejkoľvek vonkajšej pomoci) a zotaviť sa.
Rýchlosť zrážania krvi nie je možné určiť jedným parametrom, pretože do tohto procesu je zapojených veľa komponentov, ktoré sa navzájom aktivujú. V tomto ohľade sú testy zrážanlivosti krvi odlišné, kde intervaly ich normálnych hodnôt závisia hlavne od spôsobu vykonania štúdie av iných prípadoch od pohlavia osoby a dní, mesiacov a rokov, ktoré má. žil. A čitateľ pravdepodobne nebude spokojný s odpoveďou: Čas zrážania krvi je 5-10 minút. Zostáva veľa otázok...
Každý je dôležitý a každý je potrebný
Zastavenie krvácania je založené na mimoriadne zložitom mechanizme, ktorý zahŕňa mnoho biochemických reakcií, na ktorých sa podieľa obrovské množstvo rôznych zložiek, pričom každá z nich zohráva špecifickú úlohu.

vzor zrážania krvi
Neprítomnosť alebo nekonzistentnosť aspoň jedného koagulačného alebo antikoagulačného faktora môže narušiť celý proces. Tu je len niekoľko príkladov:
- Nedostatočná reakcia zo strany stien ciev porušuje krvné doštičky - čo „cíti“ primárnu hemostázu;
- Nízka schopnosť endotelu syntetizovať a vylučovať inhibítory agregácie krvných doštičiek (hlavný je prostacyklín) a prírodné antikoagulanciá () zahusťujú krv pohybujúcu sa cez cievy, čo vedie k tvorbe zrazenín v krvnom obehu, ktoré sú pre človeka absolútne zbytočné. telo, ktoré zatiaľ môže pokojne „sedieť“ pripevnené k stene ktorej alebo nádoby. Tie sa stávajú veľmi nebezpečnými, keď sa odlomia a začnú cirkulovať v krvnom obehu – čím vzniká riziko cievnej príhody;
- Neprítomnosť takého plazmatického faktora, akým je FVIII, je spôsobená chorobou viazanou na pohlavie - A;
- Hemofília B sa u človeka zistí, ak sa z rovnakých príčin (recesívna mutácia na chromozóme X, ktorá, ako je známe, u mužov vyskytuje len jedna), vyskytne deficit Christman factora (FIX).
Vo všeobecnosti to všetko začína na úrovni poškodenej cievnej steny, ktorá vylučovaním látok potrebných na zabezpečenie zrážanlivosti krvi priťahuje krvné doštičky cirkulujúce v krvnom obehu - doštičky. Napríklad „pozývanie“ krvných doštičiek na miesto nehody a podporovanie ich adhézie ku kolagénu, silnému stimulátoru hemostázy, musí začať svoju činnosť včas a dobre fungovať, aby sa v budúcnosti dalo počítať s tvorbou plnohodnotného ošúchaná zástrčka.
Ak krvné doštičky využívajú svoju funkčnosť na správnej úrovni (adhezívno-agregačná funkcia), rýchlo vstupujú do hry ďalšie zložky primárnej (vaskulárno-doštičkovej) hemostázy a v krátkom čase vytvoria doštičkovú zátku, aby sa zastavil prietok krvi z cieva mikrovaskulatúry , môžete sa zaobísť bez osobitného vplyvu ostatných účastníkov procesu zrážania krvi. Pre vytvorenie plnohodnotnej zátky schopnej uzavrieť poranenú cievu, ktorá má širší lúmen, si však telo bez plazmatických faktorov neporadí.
V prvom štádiu (bezprostredne po poranení cievnej steny) teda začínajú prebiehať postupné reakcie, kde aktivácia jedného faktora dáva impulz k uvedeniu zvyšku do aktívneho stavu. A ak niekde niečo chýba alebo sa ukáže, že faktor je neudržateľný, proces zrážania krvi sa spomalí alebo úplne zastaví.
Vo všeobecnosti mechanizmus zrážania pozostáva z 3 fáz, ktoré by mali zabezpečiť:
- Tvorba komplexného komplexu aktivovaných faktorov (protrombináza) a premena proteínu syntetizovaného pečeňou - na trombín ( fáza aktivácie);
- Transformácia proteínu rozpusteného v krvnom faktore I ( , FI) na nerozpustný fibrín sa uskutočňuje v koagulačnej fáze;
- Dokončenie koagulačného procesu vytvorením hustej fibrínovej zrazeniny ( fáza stiahnutia).

Testy zrážanlivosti krvi
Viacstupňový kaskádový enzymatický proces, ktorého konečným cieľom je vytvorenie zrazeniny, ktorá dokáže uzavrieť „medzeru“ v cieve, bude čitateľovi určite pripadať mätúce a nepochopiteľné, preto bude stačiť pripomenúť, že tento mechanizmus zabezpečujú rôzne koagulačné faktory, enzýmy, Ca 2+ (ióny vápnika) a celý rad ďalších zložiek. V tomto ohľade sa však pacienti často zaujímajú o otázku: ako zistiť, či niečo nie je v poriadku s hemostázou, alebo sa upokojiť s vedomím, že systémy fungujú normálne? Samozrejme, na takéto účely existujú testy na zrážanlivosť krvi.

Najbežnejšia špecifická (lokálna) analýza stavu hemostázy sa považuje za všeobecne známu, často predpisovanú terapeutmi, kardiológmi, ako aj pôrodníkmi-gynekológmi, za najinformatívnejšiu.
Medzitým je potrebné poznamenať, že vykonávanie takého počtu testov nie je vždy opodstatnené. Závisí to od mnohých okolností: čo lekár hľadá, v akej fáze kaskády reakcií zameriava svoju pozornosť, koľko času má k dispozícii zdravotníckych pracovníkov atď.
Simulácia vonkajšej cesty zrážania krvi
Napríklad vonkajšia dráha aktivácie zrážania v laboratóriu môže napodobňovať to, čo lekárska profesia nazýva rýchlym protrombínom, rýchlym testom, protrombínovým časom (PTT) alebo tromboplastínovým časom (všetky rôzne názvy pre rovnaký test). Tento test, ktorý závisí od faktorov II, V, VII, X, je založený na účasti tkanivového tromboplastínu (pri práci na vzorke krvi spája citrátom rekalcifikovanú plazmu).
Hranice normálnych hodnôt pre mužov a ženy rovnakého veku sa nelíšia a sú obmedzené na rozsah 78 - 142 %, avšak u žien, ktoré čakajú dieťa, je toto číslo mierne zvýšené (ale mierne!) . Naopak, u detí sú normy v medziach menších hodnôt a zvyšujú sa, keď sa blížia k dospelosti a ďalej:
Odraz vnútorného mechanizmu v laboratóriu
Medzitým, aby sa zistilo porušenie zrážanlivosti krvi v dôsledku poruchy vnútorného mechanizmu, tkanivový tromboplastín sa počas analýzy nepoužíva - to umožňuje plazme využívať iba svoje vlastné rezervy. V laboratóriu sa sleduje vnútorný mechanizmus, čaká sa, kým sa krv odobratá z ciev krvného obehu sama zrazí. Začiatok tejto komplexnej kaskádovej reakcie sa zhoduje s aktiváciou Hagemanovho faktora (faktor XII). Spustenie tejto aktivácie zabezpečujú rôzne podmienky (kontakt krvi s poškodenou cievnou stenou, bunkové membrány, ktoré prešli určitými zmenami), preto sa nazýva kontakt.
K aktivácii kontaktu dochádza aj mimo tela, napríklad keď krv vstúpi do cudzieho prostredia a dostane sa s ním do kontaktu (kontakt so sklom v skúmavke, prístrojmi). Odstránenie vápenatých iónov z krvi nijako neovplyvňuje spustenie tohto mechanizmu, proces však nemôže skončiť tvorbou zrazeniny - tá sa odlomí v štádiu aktivácie faktora IX, kde už nie je ionizovaný vápnik dosť.

Čas zrážania krvi alebo čas, počas ktorého sa v tekutom stave vyleje do formy elastickej zrazeniny, závisí od rýchlosti premeny proteínu fibrinogénu rozpusteného v plazme na nerozpustný fibrín. To (fibrín) vytvára vlákna, ktoré držia červené krvinky (erytrocyty), čo spôsobuje, že vytvárajú zväzok, ktorý uzatvára otvor v poškodenej cieve. Čas zrážania krvi (1 ml odobratý zo žily - metóda Lee-White) je v takýchto prípadoch obmedzený v priemere na 4-6 minút. Rýchlosť zrážania krvi má však, samozrejme, širší rozsah digitálnych (dočasných) hodnôt:
- Krv odobratá z žily prechádza do formy zrazeniny od 5 do 10 minút;
- Lee-White zrážací čas v sklenenej skúmavke je 5-7 minút, v silikónovej skúmavke sa predlžuje na 12-25 minút;
- V prípade krvi odobranej z prsta sa ukazovatele považujú za normálne: začiatok - 30 sekúnd, koniec krvácania - 2 minúty.
Pri prvom podozrení na hrubé porušenie zrážanlivosti krvi sa vykoná analýza, ktorá odráža vnútorný mechanizmus. Vyšetrenie je veľmi pohodlné: vykonáva sa rýchlo (kým krv netečie alebo sa v skúmavke nevytvorí zrazenina), zaobíde sa bez špeciálnych činidiel a sofistikovaného vybavenia a pacient nepotrebuje špeciálnu prípravu. Samozrejme, takto zistené poruchy zrážanlivosti krvi dávajú dôvod predpokladať množstvo významných zmien v systémoch, ktoré zabezpečujú normálny stav hemostázy, a nútia ďalší výskum na identifikáciu skutočné dôvody patológia.
So zvýšením (predĺžením) času zrážania krvi je možné podozrievať:
- Nedostatok plazmatických faktorov určených na zabezpečenie zrážanlivosti alebo ich vrodená menejcennosť napriek tomu, že sú v krvi na dostatočnej úrovni;
- Závažná patológia pečene, ktorá vedie k funkčnému zlyhaniu parenchýmu orgánu;
- (vo fáze, keď je schopnosť zrážania krvi na ústupe);
V prípade liečby heparínom sa predlžuje čas zrážania krvi, takže pacienti užívajúci tento liek musia pomerne často podstúpiť testy, ktoré indikujú stav hemostázy.
Uvažovaný indikátor zrážania krvi znižuje jeho hodnoty (skrátené):
- Vo fáze vysokej koagulácie () DIC;
- Pri iných ochoreniach, ktoré spôsobili patologický stav hemostázy, to znamená, keď pacient už má poruchy zrážanlivosti krvi a je priradený do skupiny so zvýšeným rizikom vzniku krvných zrazenín (trombóza atď.);
- U žien, ktoré dlhodobo užívajú na antikoncepciu alebo na účely liečby perorálne lieky obsahujúce hormóny;
- U žien a mužov užívajúcich kortikosteroidy (pri predpisovaní kortikosteroidov je veľmi dôležitý vek - mnohé z nich u detí a starších ľudí môžu spôsobiť výrazné zmeny hemostázy, preto je ich použitie v tejto skupine zakázané).
Vo všeobecnosti sa normy málo líšia
Ukazovatele zrážanlivosti krvi (norma) u žien, mužov a detí (čo znamená jeden vek pre každú kategóriu) sa v zásade príliš nelíšia, aj keď sa jednotlivé ukazovatele u žien fyziologicky menia (pred, počas a po menštruácii, počas tehotenstva), preto , pri dirigovaní sa stále zohľadňuje pohlavie dospelého laboratórny výskum. Navyše u žien v období nosenia dieťaťa by sa jednotlivé parametre mali dokonca trochu posunúť, pretože telo musí po pôrode zastaviť krvácanie, takže koagulačný systém sa začne pripravovať vopred. Výnimkou vo vzťahu k niektorým ukazovateľom zrážanlivosti krvi je kategória detí v prvých dňoch života, napríklad u novorodencov je PTT niekoľkonásobne vyššia ako u dospelých mužov a žien (norma pre dospelých je 11–15 sekúnd) a u predčasne narodených detí sa protrombínový čas zvyšuje o 3 - 5 sekúnd. Je pravda, že už niekde na 4. deň života PTV klesá a zodpovedá norme zrážanlivosti krvi u dospelých.

Nižšie uvedená tabuľka pomôže čitateľovi zoznámiť sa s normou jednotlivých ukazovateľov zrážanlivosti krvi a prípadne ich porovnať s vlastnými parametrami (ak bol test vykonaný relatívne nedávno a existuje formulár so záznamom výsledkov štúdie po ruke):
| Laboratórny test | Normálne hodnoty indexu zrážanlivosti krvi | Použitý materiál |
|---|---|---|
| Krvné doštičky: Medzi ženami U mužov U detí | 180 - 320 x 10 9 / l 200 - 400 x 10 9 / l 150 - 350 x 10 9 / l | kapilárna krv (z prsta) |
| Čas zrážania: Podľa Sukhareva Podľa Lee Whitea | Začiatok - 30 - 120 sekúnd, koniec - 3 - 5 minút 5 - 10 minút | kapilárnej Krv odobratá zo žily |
| Duke čas krvácania | nie viac ako 4 minúty | krv z prstov |
| trombínový čas(ukazovateľ premeny fibrinogénu na fibrín) | 12 - 20 sekúnd | venózna |
| PTI (protrombínový index): Krv z prstov Krv zo žily | 90 – 105% | kapilárnej Venózna |
| APTT (aktivovaný parciálny tromboplastínový čas, kaolínovo-kefalínový čas) | 35 - 50 sekúnd (nekoreluje s pohlavím alebo vekom) | krv zo žily |
| Fibinogén: U dospelých mužov a žien Ženy v poslednom mesiaci tretieho trimestra tehotenstva U detí prvých dní života | 2,0 – 4,0 g/l 1,25 – 3,0 g/l | Odkysličená krv |
Na záver by som chcel upozorniť našich pravidelných (a samozrejme nových) čitateľov: je možné, že čítanie prehľadového článku nebude môcť plne uspokojiť záujem pacientov postihnutých patológiou hemostázy. Ľudia, ktorí sa prvýkrát stretli s podobným problémom, chcú spravidla získať čo najviac informácií o systémoch, ktoré zaisťujú zastavenie krvácania v správnom čase a zabraňujú tvorbe nebezpečných zrazenín, a tak začnú hľadať informácie na internete. Nemali by ste sa ponáhľať - v iných častiach našej webovej stránky je uvedený podrobný (a čo je najdôležitejšie, správny) popis každého z indikátorov stavu hemostázy, je uvedený rozsah normálnych hodnôt. a sú tiež opísané indikácie a príprava na analýzu.
Video: len o zrážaní krvi
Video: reportáž o testoch zrážanlivosti krvi
Zrážanie krvi (hemokoagulácia) je najdôležitejším ochranným mechanizmom organizmu, ktorý ho chráni pred stratou krvi v prípade poškodenia. cievy väčšinou svalnatý typ. Zrážanie krvi je zložitý biochemický a fyzikálno-chemický proces, v dôsledku ktorého rozpustný krvný proteín - fibrinogén - prechádza do nerozpustného stavu - fibrínu. Zrážanie krvi je v podstate enzymatický proces. Látky zapojené do tohto procesu sa nazývajú faktory systému zrážania krvi, ktoré sa delia do dvoch skupín: 1) zabezpečujúce a urýchľujúce proces hemokoagulácie (urýchľovače); 2) jeho spomalenie alebo zastavenie (inhibítory). V krvnej plazme bolo zistených 13 faktorov hemokoagulačného systému. Väčšina faktorov sa tvorí v pečeni a na ich syntézu je potrebný vitamín K. Pri nedostatku alebo znížení aktivity faktorov zrážanlivosti krvi možno pozorovať patologické krvácanie. Najmä pri nedostatku plazmatických faktorov nazývaných antihemofilné globulíny, rôzne formy hemofília.
Proces zrážania krvi prebieha v troch fázach. V prvej fáze procesu zrážania krvi sa tvorí p trombináza. Počas fázy II procesu zrážania krvi sa tvorí aktívny proteolytický enzým trombín. Tento enzým sa objavuje v krvi ako výsledok pôsobenia protrombinázy na protrombín. Fáza III zrážania krvi je spojená s premenou fibrinogénu na fibrín pod vplyvom proteolytického enzýmu trombínu. Pevnosť vytvorenej krvnej zrazeniny zabezpečuje špeciálny enzým – faktor stabilizujúci fibrín. Nachádza sa v plazme, krvných doštičkách, červených krvinkách a tkanivách.
Vápnikové ióny sú nevyhnutné na realizáciu všetkých fáz procesu zrážania krvi. V budúcnosti sa pod vplyvom faktorov krvných doštičiek fibrínové filamenty stiahnu (stiahnutie), v dôsledku čoho zrazenina zhustne a uvoľní sa sérum. Krvné sérum sa teda svojím zložením líši od plazmy absenciou fibrinogénu a niektorých ďalších látok podieľajúcich sa na procese zrážania krvi. Krv, z ktorej bol odstránený fibrín, sa nazýva defibrinovaná. Skladá sa z tvarovaných prvkov a séra. Inhibítory hemokoagulácie interferujú s intravaskulárnou koaguláciou alebo spomaľujú tento proces. Heparín je najsilnejší inhibítor zrážania krvi.
Heparín je prírodný antikoagulant široký rozsahúčinku, tvorí sa v labrocytoch (žírnych bunkách) a bazofilných leukocytoch. Heparín inhibuje všetky fázy procesu zrážania krvi. Krv, ktorá opúšťa cievne riečisko, sa zráža a tým obmedzuje stratu krvi. V cievnom riečisku je krv tekutá, takže plní všetky svoje funkcie. Je to spôsobené tromi hlavnými dôvodmi: 1) faktory systému zrážania krvi v cievnom riečisku sú v neaktívnom stave; 2) prítomnosť antikoagulancií (inhibítorov), ktoré bránia tvorbe trombínu, v krvi, formovaných prvkoch a tkanivách; 3) prítomnosť intaktného (intaktného) vaskulárneho endotelu. Antipódom hemokoagulačného systému je fibrinolytický systém, ktorého hlavnou funkciou je štiepenie fibrínových vlákien na rozpustné zložky. Pozostáva z enzýmu plazmín (fibrinolyzín), ktorý je v krvi v neaktívnom stave, vo forme plazminogénu (profibrinolyzín), aktivátorov a inhibítorov fibrinolýzy. Aktivátory stimulujú premenu plazminogénu na plazmín, inhibítory tento proces inhibujú. Proces fibrinolýzy sa musí zvážiť v spojení s procesom zrážania krvi. Zmena funkčného stavu jedného z nich je sprevádzaná kompenzačnými posunmi v činnosti druhého. Porušenie funkčných vzťahov medzi systémami hemokoagulácie a fibrinolýzy môže viesť k závažným patologické stavy organizmu, alebo k zvýšenému krvácaniu, alebo k intravaskulárnej trombóze. Funkčný stav systému zrážania krvi a fibrinolýzy je udržiavaný a regulovaný nervovými a humorálnymi mechanizmami.
I. Fibrinogén II. Protrombín III. Krvný koagulačný faktor III (tromboplastín) IV. Ca++ ióny V. Faktor zrážania krvi V (Proaccelerin) VI. vyradené z klasifikácie VII. Krvný koagulačný faktor VII (Prokonvertín) VIII. Faktor zrážania krvi VIII (antihemofilný globulín) IX. Krvný koagulačný faktor IX (Vianočný faktor) X. Krvný koagulačný faktor X (Stuart-Prowerov faktor) XI. Faktor zrážanlivosti krvi XI (Rosenthalov faktor) XII. Krvný koagulačný faktor XII (Hagemanov faktor) XIII. Fibrináza (faktor stabilizujúci fibrín, Fletcherov faktor)
Súčasne s primárnou (vaskulárno-doštičkovou) hemostázou vzniká sekundárna (koagulačná) hemostáza, ktorá zabezpečuje zastavenie krvácania z tých ciev, na ktoré predchádzajúce štádium nestačí. Zátka krvných doštičiek zlyhá vysoký tlak krvi a so znížením reakcie reflexného kŕče sa môže vyplaviť: Preto sa vytvorí skutočný trombus, ktorý ho nahradí. Základom pre vznik trombu je prechod rozpusteného fibrinogénu (FI) na nerozpustný fibrín za vzniku siete, do ktorej sú zapletené krvinky. Fibrín sa tvorí pod vplyvom enzýmu trombínu. Normálne v krvi nie je žiadny trombín. Obsahuje svojho predchodcu, má neaktívnu formu. Toto je protrombín (F-II). Na aktiváciu protrombínu potrebujete vlastný enzým – protrombinázu. Proces tvorby aktívnej protrombinázy je zložitý, vyžaduje interakciu mnohých faktorov v plazme, bunkách, tkanivách a trvá 5-7 minút. Všetky procesy koagulačnej hemostázy sú enzymatické. Vyskytujú sa ako sériová kaskáda. Fáza tvorby protrombinázy je zložitá a dlhá. Základom tvorby enzýmu protrombinázy je lipidový faktor. Podľa typu pôvodu sa rozlišujú tkanivové (vonkajšie) a plazmatické (vnútorné) mechanizmy. Tkanivová protrombináza sa objaví 5–10 s po poranení a krvná protrombináza sa objaví až po 5–7 minútach.
tkanivová protrombináza. S tvorbou tkanivovej protrombinázy sa faktor lipidového aktivátora uvoľňuje z membrán poškodených tkanív, stien krvných ciev. Najprv sa aktivuje F-VII. F-VIIa spolu s tkanivovými fosfolipidmi a vápnikom tvorí komplex 1a. F-X sa aktivuje pod vplyvom tohto komplexu. Fosfolipidy F-Xa sa tvoria za účasti Ca2 + a F-V komplex 3, čo je tkanivová protrombináza. Tkanivová protrombináza aktivuje malé množstvo trombínu, ktorý sa využíva najmä pri reakcii agregácie krvných doštičiek. Okrem toho bola odhalená ďalšia funkcia trombínu tvorená vonkajším mechanizmom – pod jeho vplyvom sa na membráne agregovaných krvných doštičiek vytvárajú receptory, na ktoré sa môže adsorbovať F-Xa. V dôsledku toho sa F-Xa stáva nedostupným pre jeden z najsilnejších antikoagulancií – antitrombín III. To je predpokladom pre následnú tvorbu skutočného trombu krvných doštičiek v danom mieste.
Krvná protrombináza vzniká na báze fosfolipidov v membránach poškodených krviniek (krvné doštičky, erytrocyty). Iniciátorom tohto procesu sú kolagénové vlákna, ktoré sa objavia pri poškodení cievy. V dôsledku kontaktu kolagénu s F-XII sa spustí kaskáda enzymatických procesov. Aktivovaný F-ChIIa tvorí prvý komplex s F-Chia na fosfolipidoch membrán erytrocytov a krvných doštičiek, ktoré sa stále ničia. Toto je najpomalšia reakcia, trvá 4-7 minút.
Ďalšie reakcie sa vyskytujú aj na fosfolipidovej matrici, ale ich rýchlosť je oveľa vyššia. Pod vplyvom komplexu vzniká komplex 2, ktorý pozostáva z F-Ixa, F-VIII a Ca2 +. Tento komplex aktivuje F-X. Nakoniec F-Xa fosfolipidovej matrice tvorí 3-krvný protrombinázový komplex (Xa + V + + Ga2 +).
Druhou fázou zrážania krvi je tvorba trombínu. Za 2-5 s po vytvorení protrombinázy sa trombín vytvorí takmer okamžite (za 2-5 s) ??. Plazmatický proteín protrombín (a2-globulín, má molekulovú hmotnosť 68 700) sa nachádza v plazme (0,15 g/l). Krvná protrombináza adsorbuje p/trombín na svojom povrchu a premieňa ho na trombín.
Treťou fázou je premena fibrinogénu na fibrín. Pod vplyvom trombínu sa plazmatický fibrinogén premieňa na fibrín. Tento proces prebieha v 3 etapách. Najprv sa fibrinogén (molekulová hmotnosť 340 000; normálne obsiahnutý v koncentrácii 1 až 7 g/l) rozdelí na 2 podjednotky v prítomnosti Ca2+. Každý z nich pozostáva z 3 polypeptidových reťazcov - a, d, Y. Tieto sólu podobné fibrínové monoméry sa pôsobením elektrostatických síl stávajú navzájom paralelnými a vytvárajú fibrínové polyméry. To si vyžaduje Ca2 + a plazmatický faktor Fibrinopeptidy A. Výsledný gél sa ešte môže rozpustiť. Nazýva sa fibrín S. V tretej fáze sa tvoria kovalentné väzby za účasti F-CNE a tkanivovej fibrinázy, krvných doštičiek, erytrocytov a Ca2 + a fibrín S sa mení na nerozpustný fibrín 1. Výsledkom je relatívne mäkká guľa sa tvoria fibrínové vlákna, do ktorých sú zapletené krvné doštičky, erytrocyty a leukocyty, čo vedie k ich deštrukcii. To prispieva k lokálnemu zvýšeniu koncentrácií koagulačných faktorov a membránových fosfolipidov a hemoglobín uvoľnený z erytrocytov poskytuje krvné zrazeniny zodpovedajúcej farby.
Zrážanie krvi je mimoriadne zložitý a v mnohých ohľadoch stále záhadný biochemický proces, ktorý začína pri poškodení obehového systému a vedie k premene krvnej plazmy na želatínovú zrazeninu, ktorá upchá ranu a zastaví krvácanie. Porušenia tohto systému sú mimoriadne nebezpečné a môžu viesť ku krvácaniu, trombóze alebo iným patológiám, ktoré sú spolu zodpovedné za leví podiel úmrtí a invalidity modernom svete. Tu zvážime zariadenie tohto systému a porozprávame sa o najnovších úspechoch v jeho štúdii.
Každý, kto aspoň raz v živote utrpel škrabanec alebo ranu, tak získal úžasnú príležitosť pozorovať premenu krvi z tekutiny na viskóznu netekutú hmotu, ktorá vedie k zastaveniu krvácania. Tento proces sa nazýva zrážanie krvi a je riadený zložitým systémom biochemických reakcií.
Mať nejaký druh systému kontroly krvácania je absolútne nevyhnutné pre každý mnohobunkový organizmus, ktorý má tekuté vnútorné prostredie. Zrážanie krvi je pre nás tiež životne dôležité: mutácie v génoch pre hlavné zrážacie bielkoviny sú zvyčajne smrteľné. Bohužiaľ, medzi mnohými systémami nášho tela, ktorých porušenie predstavuje nebezpečenstvo pre zdravie, zrážanie krvi tiež zaujíma absolútne prvé miesto ako hlavná bezprostredná príčina smrti: ľudia trpia rôznymi chorobami, no takmer vždy zomierajú na poruchy zrážanlivosti krvi. Rakovina, sepsa, trauma, ateroskleróza, srdcový infarkt, mozgová príhoda – pri najširšom spektre chorôb je bezprostrednou príčinou smrti neschopnosť koagulačného systému udržať rovnováhu medzi tekutým a pevným stavom krvi v tele.
Ak je príčina známa, prečo s ňou nezabojovať? Samozrejme, je možné a potrebné bojovať: vedci neustále vytvárajú nové metódy na diagnostiku a liečbu porúch zrážanlivosti. Problém je však v tom, že zrážací systém je veľmi zložitý. A veda o regulácii zložitých systémov učí, že takéto systémy je potrebné riadiť špeciálnym spôsobom. Ich reakcia na vonkajšie vplyvy je nelineárna a nepredvídateľná a aby ste dosiahli želaný výsledok, musíte vedieť, kde vynaloženú námahu uplatniť. Najjednoduchšie prirovnanie: na vypustenie papierového lietadla do vzduchu stačí hodiť ho správnym smerom; zároveň, aby lietadlo vzlietlo, musíte stlačiť správne tlačidlá v kokpite v správnom čase a v správnom poradí. A ak sa pokúsite spustiť lietadlo hodom, ako papierové lietadlo, skončí to zle. Tak je to aj s koagulačným systémom: na úspešnú liečbu potrebujete poznať „kontrolné body“.
Až donedávna zrážanie krvi úspešne odolávalo pokusom výskumníkov pochopiť jeho fungovanie, a to iba v posledné roky nastal kvantový skok. V tomto článku budeme hovoriť o tomto úžasnom systéme: ako funguje, prečo je také ťažké ho študovať, a čo je najdôležitejšie, budeme hovoriť o najnovších objavoch v chápaní toho, ako funguje.
Ako prebieha zrážanie krvi
Zastavenie krvácania je založené na rovnakej myšlienke, akú používajú gazdinky na prípravu rôsolovitého mäsa – premene tekutiny na gél (koloidný systém, v ktorom sa vytvára sieť molekúl, ktoré dokážu vo svojich bunkách zadržať tekutinu, ktorá má tisíckrát väčšiu hmotnosť. na vodíkové väzby s molekulami vody). Mimochodom, rovnaký nápad sa používa v jednorazových detských plienkach, v ktorých je umiestnený materiál, ktorý pri navlhčení napučí. Z fyzického hľadiska je potrebné vyriešiť rovnaký problém ako pri obmedzovaní - boj proti zatekaniu s minimálnym úsilím.
Zrážanie krvi je ústredné hemostáza(zastavenie krvácania). Druhým článkom hemostázy je špeciálne bunky - krvných doštičiek, - schopné pripojiť sa k sebe a k miestu poranenia, aby vytvorili zátku zastavujúcu krv.
Všeobecnú predstavu o biochémii koagulácie možno získať z obrázku 1, ktorý ukazuje reakciu premeny rozpustného proteínu fibrinogén v fibrín, ktorý následne polymerizuje do siete. Táto reakcia je jedinou časťou kaskády, ktorá má priamy fyzikálny význam a rieši jasný fyzikálny problém. Úloha zostávajúcich reakcií je výlučne regulačná: zabezpečiť premenu fibrinogénu na fibrín len na správnom mieste a v správnom čase.
Obrázok 1. Hlavné reakcie zrážania krvi. Koagulačný systém je kaskáda – sled reakcií, kde produkt každej reakcie pôsobí ako katalyzátor ďalšej. Hlavný „vstup“ do tejto kaskády je v jej strednej časti, na úrovni faktorov IX a X: proteín tkanivový faktor(v diagrame označený ako TF) viaže faktor VIIa a výsledný enzymatický komplex aktivuje faktory IX a X. Výsledkom kaskády je fibrínový proteín, ktorý môže polymerizovať a vytvárať zrazeninu (gél). Prevažná väčšina aktivačných reakcií sú proteolýzne reakcie, t.j. čiastočné štiepenie proteínu, zvýšenie jeho aktivity. Takmer každý koagulačný faktor je nevyhnutne inhibovaný tak či onak: spätná väzba je nevyhnutná pre stabilnú prevádzku systému.
Označenia: Sú znázornené reakcie na premenu koagulačných faktorov na aktívne formy jednostranné tenké čierne šípky. V čom kučeravé červené šípky ukazujú, ktoré enzýmy sú aktivované. Sú znázornené reakcie na stratu aktivity v dôsledku inhibície tenké zelené šípky(pre jednoduchosť sú šípky zobrazené ako jednoducho "odchádzajúce", t.j. nie je znázornené, na ktoré inhibítory sa viažu). Sú znázornené reverzibilné reakcie tvorby komplexov obojstranné tenké čierne šípky. Koagulačné proteíny sú označené buď názvami, rímskymi číslicami alebo skratkami ( TF- tkanivový faktor, PC- proteín C, APC- aktivovaný proteín C). Aby sa predišlo prekrveniu, schéma neukazuje: väzbu trombínu na trombomodulín, aktiváciu a sekréciu krvných doštičiek, kontaktnú aktiváciu koagulácie.
Fibrinogén sa podobá tyčinke s dĺžkou 50 nm a hrúbkou 5 nm (obr. 2 ale). Aktivácia umožňuje jeho molekulám zlepiť sa do fibrínového vlákna (obr. 2 b), a potom do vlákna schopného rozvetviť sa a vytvoriť trojrozmernú sieť (obr. 2 v).

Obrázok 2. Fibrínový gél. ale - Schematické usporiadanie molekuly fibrinogénu. Jeho základ tvoria tri páry zrkadlovo obrazových polypeptidových reťazcov α, β, γ. V strede molekuly je možné vidieť väzbové oblasti, ktoré sa stanú dostupnými, keď trombín preruší fibrinopeptidy A a B (FPA a FPB na obrázku). b - Mechanizmus zostavovania fibrínových vlákien: molekuly sú navzájom spojené "prekryté" podľa princípu hlava-stred a tvoria dvojvláknové vlákno. v - Snímka gélu z elektrónového mikroskopu: fibrínové vlákna sa môžu zlepovať a štiepiť, čím vytvárajú komplexnú trojrozmernú štruktúru.

Obrázok 3. Trojrozmerná štruktúra molekuly trombínu. Schéma ukazuje aktívne miesto a časti molekuly zodpovedné za väzbu trombínu na substráty a kofaktory. (Aktívne miesto je časť molekuly, ktorá priamo rozpoznáva miesto štiepenia a vykonáva enzymatickú katalýzu.) Vyčnievajúce časti molekuly (exozity) umožňujú „prepínanie“ molekuly trombínu, čím sa stáva multifunkčným proteínom schopným pôsobiť v rôzne režimy. Napríklad väzba trombomodulínu na exozit I fyzicky blokuje prístup k trombínu pre prokoagulačné substráty (fibrinogén, faktor V) a alostericky stimuluje aktivitu voči proteínu C.
Fibrinogénový aktivátor trombín (obr. 3) patrí do rodiny serínových proteináz, enzýmov schopných štiepiť peptidové väzby v proteínoch. Súvisí s tráviacimi enzýmami trypsínom a chymotrypsínom. Proteinázy sa syntetizujú v neaktívnej forme tzv zymogén. Na ich aktiváciu je potrebné rozštiepiť peptidovú väzbu, ktorá drží časť proteínu, ktorá uzatvára aktívne miesto. Trombín sa teda syntetizuje ako protrombín, ktorý sa môže aktivovať. Ako je možné vidieť na obr. 1 (kde je protrombín označený ako faktor II), je to katalyzované faktorom Xa.
Vo všeobecnosti sa zrážacie proteíny nazývajú faktory a sú očíslované rímskymi číslicami v poradí ich oficiálneho objavu. Index "a" znamená aktívnu formu a jej absenciu - neaktívneho predchodcu. Pre dlho objavené proteíny, ako je fibrín a trombín, sa používajú aj vlastné mená. Niektoré čísla (III, IV, VI) sa z historických dôvodov nepoužívajú.
Aktivátorom zrážanlivosti je proteín tzv tkanivový faktor prítomný v bunkových membránach všetkých tkanív, s výnimkou endotelu a krvi. Krv teda zostáva tekutá len vďaka tomu, že je normálne chránená tenkou ochrannou membránou endotelu. Pri akomkoľvek porušení celistvosti cievy tkanivový faktor viaže faktor VIIa z plazmy a ich komplex tzv. vonkajšie napätie(tenase alebo Xase, od slova desať- desať, t.j. počet aktivovaných faktorov) - aktivuje faktor X.
Trombín tiež aktivuje faktory V, VIII, XI, čo vedie k zrýchleniu jeho vlastnej produkcie: faktor XIa aktivuje faktor IX a faktory VIIIa a Va viažu faktory IXa a Xa, čím sa ich aktivita rádovo zvýši (komplex faktory IXa a VIIIa sa nazývajú vnútorné napätie). Nedostatok týchto proteínov vedie k závažným poruchám: napríklad absencia faktorov VIII, IX alebo XI spôsobuje vážne ochorenie. hemofília(slávna "kráľovská choroba", ktorá bola chorá s carevičom Alexejom Romanovom); a nedostatok faktorov X, VII, V alebo protrombínu je nezlučiteľný so životom.
Takéto zariadenie je tzv Pozitívna spätná väzba: Trombín aktivuje proteíny, ktoré urýchľujú jeho vlastnú tvorbu. A tu vyvstáva zaujímavá otázka, prečo sú potrebné? Prečo nie je možné okamžite urobiť reakciu rýchlou, prečo ju príroda najprv spomalí a potom príde na spôsob, ako ju ešte urýchliť? Prečo dochádza k duplicite v systéme zrážanlivosti? Faktor X môže byť napríklad aktivovaný komplexom VIIa-TF (externá tenáza) a komplexom IXa-VIIIa (vnútorná tenáza); vyzera to uplne zbytocne.
V krvi sa nachádzajú aj inhibítory zrážacích proteináz. Hlavnými sú antitrombín III a inhibítor dráhy tkanivového faktora. Okrem toho je trombín schopný aktivovať serínovú proteinázu. proteín C, ktorý štiepi koagulačné faktory Va a VIIIa, čím úplne strácajú svoju aktivitu.
Proteín C je prekurzorom serínovej proteinázy, veľmi podobný faktorom IX, X, VII a protrombínu. Aktivuje sa trombínom, rovnako ako faktor XI. Keď je však aktivovaná, výsledná serínová proteináza využíva svoju enzymatickú aktivitu nie na aktiváciu iných proteínov, ale na ich inaktiváciu. Aktivovaný proteín C produkuje niekoľko proteolytických štiepení v koagulačných faktoroch Va a VIIIa, čo spôsobuje, že úplne strácajú svoju kofaktorovú aktivitu. Trombín – produkt koagulačnej kaskády – teda inhibuje svoju vlastnú produkciu: ide o tzv negatívna odozva. A opäť tu máme regulačnú otázku: prečo trombín súčasne zrýchľuje a spomaľuje svoju vlastnú aktiváciu?
Evolučné počiatky skladania
Tvorba ochranných krvných systémov sa začala v mnohobunkových organizmoch pred viac ako miliardou rokov - v skutočnosti práve v súvislosti s objavením sa krvi. Samotný koagulačný systém je výsledkom prekonania ďalšieho historického míľnika – vzniku stavovcov asi pred päťsto miliónmi rokov. S najväčšou pravdepodobnosťou tento systém vznikol z imunity. Vznik ďalšieho systému imunitných reakcií, ktorý bojoval proti baktériám tým, že ich obalil fibrínovým gélom, viedol k náhodnému vedľajšiemu účinku: krvácanie sa začalo rýchlejšie zastavovať. To umožnilo zvýšiť tlak a silu prítokov obehový systém a zlepšenie cievny systém, teda zlepšenie transportu všetkých látok, otvorilo nové obzory pre rozvoj. Ktovie, či výskyt vrások nebol tou výhodou, ktorá umožnila stavovcom zaujať ich súčasné miesto v biosfére Zeme?
U mnohých článkonožcov (ako sú podkovičky) existuje aj koagulácia, ktorá však vznikla nezávisle a zostala v imunologických úlohách. Hmyz, podobne ako ostatné bezstavovce, si väčšinou vystačí so slabšou verziou systému kontroly krvácania založeného na agregácii krvných doštičiek (presnejšie amoebocytov – vzdialených príbuzných krvných doštičiek). Tento mechanizmus je celkom funkčný, ale kladie zásadné obmedzenia na účinnosť cievneho systému, rovnako ako tracheálne dýchanie obmedzuje maximálnu možnú veľkosť hmyzu.
Bohužiaľ, stvorenia so strednými formami zrážanlivosti sú takmer všetky vyhynuté. Jedinou výnimkou sú ryby bez čeľustí: genomická analýza koagulačného systému lamprey ukázala, že obsahuje oveľa menej komponentov (to znamená, že je oveľa jednoduchší). Od čeľusťových rýb po cicavce sú koagulačné systémy veľmi podobné. Systémy bunkovej hemostázy tiež fungujú na podobných princípoch, napriek skutočnosti, že malé, bezjadrové doštičky sú jedinečné pre cicavce. U iných stavovcov sú krvné doštičky veľké bunky s jadrom.
Stručne povedané, koagulačný systém je veľmi dobre pochopený. Počas pätnástich rokov v nej neboli objavené žiadne nové proteíny ani reakcie, čo je pre modernú biochémiu večnosť. Samozrejme, možnosť takéhoto objavu nemožno úplne vylúčiť, no zatiaľ neexistuje jediný jav, ktorý by sme pomocou dostupných informácií nevedeli vysvetliť. Skôr naopak, systém vyzerá oveľa komplikovanejšie, než je potrebné: pripomíname, že z celej tejto (dosť ťažkopádnej!) kaskády sa v skutočnosti podieľa iba jedna reakcia na gélovanie a všetky ostatné sú potrebné na nejaký druh nepochopiteľného regulácia.
To je dôvod, prečo teraz výskumníci-koagulológovia pracujúci v rôznych oblastiach - od klinickej hemostaziológie po matematickú biofyziku - aktívne prechádzajú od otázky "Ako je zložený?" na otázky "Prečo je zložený tak, ako je?", "Ako to funguje?" a nakoniec "Ako musíme ovplyvniť zrážanlivosť, aby sme dosiahli požadovaný účinok?". Prvá vec, ktorú musíte urobiť, aby ste mohli odpovedať, je naučiť sa študovať celú zrážanlivosť a nielen jednotlivé reakcie.
Ako vyšetriť koaguláciu?
Na štúdium koagulácie sa vytvárajú rôzne modely - experimentálne a matematické. Čo presne vám umožňujú získať?
Na jednej strane sa zdá, že najlepším priblížením na štúdium objektu je samotný objekt. V tomto prípade osoba alebo zviera. To vám umožní vziať do úvahy všetky faktory, vrátane prietoku krvi cez cievy, interakcie so stenami krvných ciev a oveľa viac. V tomto prípade však zložitosť problému presahuje rozumné hranice. Konvolučné modely umožňujú zjednodušiť predmet štúdia bez straty jeho podstatných vlastností.
Pokúsme sa získať predstavu o tom, aké požiadavky by tieto modely mali spĺňať, aby správne odrážali proces skladania. in vivo.
Experimentálny model by mal obsahovať rovnaké biochemické reakcie ako v tele. Prítomné by mali byť nielen proteíny koagulačného systému, ale aj ďalší účastníci koagulačného procesu – krvinky, endotel a subendotel. Systém musí brať do úvahy priestorovú heterogenitu koagulácie in vivo: aktivácia z poškodenej oblasti endotelu, šírenie aktívnych faktorov, prítomnosť prietoku krvi.
Vzhľadom na koagulačné modely je prirodzené začať metódami na štúdium koagulácie. in vivo. Základom takmer všetkých používaných prístupov tohto druhu je spôsobenie kontrolovaného poškodenia pokusnému zvieraťu s cieľom vyvolať hemostatickú alebo trombotickú reakciu. Táto reakcia sa študuje rôznymi metódami:
- sledovanie času krvácania;
- analýza plazmy odobratej zo zvieraťa;
- pitva zabitého zvieraťa a histologické vyšetrenie;
- monitorovanie trombu v reálnom čase pomocou mikroskopie alebo nukleárnej magnetickej rezonancie (obr. 4).

Obrázok 4. Tvorba trombu in vivo v modeli trombózy vyvolanej laserom. Tento obrázok je reprodukovaný z historickej práce, kde vedci mohli po prvý raz pozorovať vývoj krvnej zrazeniny „naživo“. Za týmto účelom bol do krvi myši injikovaný koncentrát fluorescenčne značených protilátok proti koagulačným proteínom a krvným doštičkám a umiestnením zvieraťa pod šošovku konfokálneho mikroskopu (umožňujúceho trojrozmerné skenovanie), arteriola pod kožou prístupná pre optické bolo vybrané pozorovanie a endotel bol poškodený laserom. Na rastúcu zrazeninu sa začali pripájať protilátky, vďaka čomu bolo možné ju pozorovať.
Klasické nastavenie experimentu zrážania in vitro spočíva v tom, že krvná plazma (alebo celá krv) sa zmieša v určitej nádobe s aktivátorom, po čom sa sleduje proces zrážania. Podľa spôsobu pozorovania možno experimentálne techniky rozdeliť do nasledujúcich typov:
- pozorovanie samotného procesu zrážania;
- pozorovanie zmien koncentrácií koagulačných faktorov v priebehu času.
Druhý prístup poskytuje neporovnateľne viac informácií. Teoreticky, ak poznáme koncentrácie všetkých faktorov v ľubovoľnom časovom bode, je možné získať úplné informácie o systéme. V praxi je štúdium dokonca dvoch proteínov súčasne nákladné a spojené s veľkými technickými ťažkosťami.
Nakoniec koagulácia v tele prebieha nehomogénne. Tvorba zrazeniny začína na poškodenej stene, šíri sa za účasti aktivovaných krvných doštičiek v objeme plazmy a zastavuje sa pomocou cievneho endotelu. Nie je možné adekvátne študovať tieto procesy klasickými metódami. Po druhé dôležitým faktorom je prítomnosť prietoku krvi v cievach.
Uvedomenie si týchto problémov viedlo od 70. rokov 20. storočia k vzniku rôznych prietokových experimentálnych systémov. in vitro. Na uvedomenie si priestorových aspektov problému bolo potrebné trochu viac času. Až v 90. rokoch sa začali objavovať metódy, ktoré zohľadňujú priestorovú heterogenitu a difúziu koagulačných faktorov a až v poslednom desaťročí sa aktívne využívajú aj vo vedeckých laboratóriách (obr. 5).

Obrázok 5. Priestorový rast fibrínovej zrazeniny za normálnych a patologických podmienok. Koaguláciu v tenkej vrstve krvnej plazmy aktivoval tkanivový faktor imobilizovaný na stene. Na fotkách sa nachádza aktivátor vľavo. Sivý rozšírený pruh- rastúca fibrínová zrazenina.
Spolu s experimentálnymi prístupmi sa na štúdium hemostázy a trombózy využívajú aj matematické modely (táto metóda výskumu sa často nazýva tzv. in silico). Matematické modelovanie v biológii umožňuje vytvoriť hlboké a zložité vzťahy medzi biologickou teóriou a skúsenosťou. Experiment má určité hranice a je spojený s množstvom ťažkostí. Okrem toho niektoré teoreticky možné experimenty nie sú uskutočniteľné alebo neúmerne drahé kvôli obmedzeniam experimentálnej techniky. Simulácia zjednodušuje experimenty, pretože je možné vopred vybrať potrebné podmienky na experimenty in vitro A in vivo, pri ktorej bude pozorovaný efekt záujmu.
Regulácia koagulačného systému

Obrázok 6. Príspevok vonkajšej a vnútornej tenázy k vytvoreniu fibrínovej zrazeniny v priestore. Použili sme matematický model, aby sme preskúmali, ako ďaleko sa môže rozšíriť vplyv aktivátora zrážania (tkanivového faktora) vo vesmíre. Na tento účel sme vypočítali distribúciu faktora Xa (ktorý určuje distribúciu trombínu, ktorý určuje distribúciu fibrínu). Animácia ukazuje distribúciu faktora Xa, vyrobené vonkajším pnutím(komplex VIIa–TF) príp vnútorné napätie(komplex IXa–VIIIa), ako aj celkové množstvo faktora Xa (tieňovaná oblasť). (Vložka ukazuje to isté na väčšej koncentračnej stupnici.) Je možné vidieť, že faktor Xa produkovaný na aktivátore nemôže preniknúť ďaleko od aktivátora v dôsledku vysoká rýchlosť plazmatická inhibícia. Naopak, komplex IXa–VIIIa pôsobí preč od aktivátora (pretože faktor IXa je inhibovaný pomalšie, a preto má väčšiu efektívnu difúznu vzdialenosť od aktivátora) a zabezpečuje distribúciu faktora Xa v priestore.
Urobme ďalší logický krok a skúsme si odpovedať na otázku – ako funguje vyššie popísaný systém?
Kaskádový koagulačný systém
Začnime kaskádou – reťazcom enzýmov, ktoré sa navzájom aktivujú. Jeden enzým, ktorý beží konštantnou rýchlosťou, poskytuje lineárnu závislosť koncentrácie produktu od času. Na kaskáde N enzýmov, bude mať táto závislosť podobu t N, kde t- čas. Pre efektívnu činnosť systému je dôležité, aby odozva mala práve taký „výbušný“ charakter, pretože to minimalizuje obdobie, kedy je fibrínová zrazenina ešte krehká.
Spúšťanie koagulácie a úloha pozitívnych spätných väzieb
Ako bolo uvedené v prvej časti článku, mnohé reakcie zrážania sú pomalé. Napríklad faktory IXa a Xa sú samy o sebe veľmi slabými enzýmami a na efektívne fungovanie vyžadujú kofaktory (faktory VIIIa a Va). Tieto kofaktory sú aktivované trombínom: takéto zariadenie, keď enzým aktivuje svoju vlastnú produkciu, sa nazýva pozitívna slučka. spätná väzba.
Ako sme experimentálne a teoreticky ukázali, pozitívna spätná väzba aktivácie faktora V trombínom tvorí aktivačný prah - vlastnosť systému nereagovať na malú aktiváciu, ale rýchlo pracovať, keď sa objaví veľká. Zdá sa, že táto schopnosť prepínania je veľmi cenná pre obmedzovanie: pomáha predchádzať „falošným pozitívam“ systému.
Úloha vnútornej dráhy v priestorovej dynamike koagulácie
Jednou zo zaujímavých záhad, ktoré prenasledovali biochemikov mnoho rokov po objavení hlavných koagulačných proteínov, bola úloha faktora XII pri hemostáze. Jeho nedostatok bol zistený v najjednoduchších testoch zrážanlivosti, čím sa predĺžil čas potrebný na tvorbu zrazeniny, avšak na rozdiel od nedostatku faktora XI nebol sprevádzaný poruchami zrážanlivosti.
Jednu z najpravdepodobnejších možností na rozlúštenie úlohy vnútornej cesty sme navrhli pomocou priestorovo nehomogénnych experimentálnych systémov. Zistilo sa, že pozitívne ohlasy majú veľký význam len na šírenie koagulácie. Účinná aktivácia faktora X vonkajšou tenázou na aktivátore nepomôže vytvoriť zrazeninu preč z aktivátora, pretože faktor Xa je v plazme rýchlo inhibovaný a nemôže sa vzdialiť od aktivátora. Ale faktor IXa, ktorý je inhibovaný rádovo pomalšie, je toho celkom schopný (a pomáha mu faktor VIIIa, ktorý je aktivovaný trombínom). A tam, kde je pre neho ťažké dosiahnuť, začína pôsobiť faktor XI, aktivovaný tiež trombínom. Prítomnosť slučiek pozitívnej spätnej väzby teda pomáha vytvárať trojrozmernú štruktúru zhlukov.
Dráha proteínu C ako možný mechanizmus lokalizácie tvorby trombu
Aktivácia proteínu C samotným trombínom je pomalá, ale prudko sa zrýchľuje, keď sa trombín naviaže na transmembránový proteín trombomodulín syntetizovaný endotelovými bunkami. Aktivovaný proteín C je schopný ničiť faktory Va a VIIIa, čím spomaľuje koagulačný systém rádovo. Priestorovo nehomogénne experimentálne prístupy sa stali kľúčom k pochopeniu úlohy tejto reakcie. Naše experimenty naznačili, že zastavuje priestorový rast trombu a obmedzuje jeho veľkosť.
Zhrnutie
V posledných rokoch sa zložitosť koagulačného systému postupne stáva menej záhadnou. Objavenie všetkých podstatných komponentov systému, vývoj matematických modelov a využitie nových experimentálnych prístupov umožnilo poodhaliť závoj tajomstva. Štruktúra koagulačnej kaskády sa dešifruje a teraz, ako sme videli vyššie, pre takmer každú podstatnú časť systému bola identifikovaná alebo navrhnutá úloha, ktorú zohráva pri regulácii celého procesu.
Obrázok 7 predstavuje najnovší pokus o prehodnotenie štruktúry systému zrážanlivosti. Ide o rovnaký obvod ako na obr. 1, kde sú časti systému zodpovedné za rôzne úlohy zvýraznené viacfarebným tieňovaním, ako je uvedené vyššie. Nie všetko v tomto okruhu je bezpečne nainštalované. Napríklad naša teoretická predpoveď, že aktivácia faktora VII faktorom Xa umožňuje zrážanie na prahovú odpoveď na prietok, zostáva zatiaľ experimentálne netestovaná.
Abstrakt z knihy „Základy klinickej hirudoterapie“ od N.I. Sulim
Pod pojmom "hemostáza" sa rozumie komplex reakcií zameraných na zastavenie krvácania v prípade poranenia cievy. V skutočnosti je význam hemostatických systémov oveľa komplexnejší a ďaleko presahuje kontrolu krvácania. Hlavnými úlohami hemostatického systému je zachovanie tekutého stavu cirkulujúcej a deponovanej krvi, regulácia transkapilárneho metabolizmu, odporu cievnej steny a ovplyvnenie intenzity reparačných procesov.
Je obvyklé rozlišovať medzi: vaskulárno-doštičkovou hemostázou a procesom zrážania krvi. V prvom prípade hovoríme o zastavení krvácania z malých krvných ciev s nízkym krvným tlakom, ktorých priemer nepresahuje 100 mikrónov, v druhom prípade ide o boj so stratou krvi pri poškodení tepien a žíl. Takéto rozdelenie je podmienené, pretože v prípade poškodenia malých aj veľkých krvných ciev vždy dochádza k zrážaniu krvi spolu s tvorbou zátky krvných doštičiek.
Zároveň je takéto rozdelenie pre lekárov mimoriadne výhodné, pretože v prípade porušenia hemostázy cievnych doštičiek je prepichnutie kože prsta alebo ušného laloku sprevádzané predĺženým krvácaním, zatiaľ čo čas zrážania krvi zostáva normálny. V patológii systému zrážania krvi sa čas krvácania výrazne nemení, hoci tvorba fibrínovej zrazeniny sa nemusí vyskytnúť niekoľko hodín, čo sa pozoruje najmä pri hemofílii A a B.
Hemostáza cievnych krvných doštičiek
Hemostáza cievnych krvných doštičiek je znížená na tvorbu zátky krvných doštičiek alebo trombu krvných doštičiek.
Tri štádiá vaskulárno-doštičkovej hemostázy
- dočasný (primárny a sekundárny) vazospazmus;
- tvorba zátky krvných doštičiek v dôsledku adhézie (prichytenie k poškodenému povrchu) a agregácie (zlepenia) krvných doštičiek;
- retrakcia (kontrakcia a zhutnenie) zátky krvných doštičiek.
Dočasný vazospazmus
Doslova zlomok sekundy po zranení existuje primárny kŕč do krvných ciev, kvôli ktorým sa krvácanie v prvom momente nemusí vyskytnúť alebo je obmedzené. Primárny vazospazmus je spôsobený uvoľňovaním adrenalínu a noradrenalínu do krvi v reakcii na podráždenie bolesti a netrvá dlhšie ako 10-15 sekúnd. Neskôr príde sekundárny kŕč, v dôsledku aktivácie krvných doštičiek a uvoľňovania vazokonstrikčných látok do krvi - serotonínu, TxA 2, adrenalínu atď.
Primárna (reverzibilná) agregácia krvných doštičiek
Poškodenie ciev je sprevádzané okamžitou aktiváciou krvných doštičiek, ktorá je spojená s výskytom vysokých koncentrácií ADP (z kolabujúcich erytrocytov a poranených ciev), ako aj s obnažením subendotelu, kolagénu a fibrilárnych štruktúr. Začína sa adhézia krvných doštičiek ku kolagénu a iným adhezívnym proteínom subendotelu.
Pri poškodení veľkých tepien a žíl sa krvné doštičky prilepia priamo na obnažené kolagénové vlákna cez kolagénové receptory – GP-Ib-IIa.
Pri traume malých tepien a arteriol je adhézia krvných doštičiek spôsobená prítomnosťou v plazme a krvných doštičkách, ako aj uvoľnením špeciálneho proteínu z endotelu - von Willebrandovho faktora (vWF), ktorý má 3 aktívne centrá, z ktorých dve sa viažu na receptory krvných doštičiek (GPIb) a jeden - so subendotelovými alebo kolagénovými vláknami. Doštička sa teda pomocou vWF „zavesí“ na poranený povrch cievy.
Z priľnutých krvných doštičiek, ako aj z poškodeného endotelu sa uvoľňuje ADP, ktorý je najdôležitejším induktorom agregácie. Pod vplyvom ADP krvné doštičky priľnú k krvným doštičkám pripojeným k endotelu a tiež sa zlepia a tvoria agregáty, ktoré sú základom doštičkovej zátky. Zvýšenú agregáciu napomáha faktor aktivujúci doštičky (PAF), ako aj trombín, ktorý sa vždy objavuje v dôsledku zrážania krvi v oblasti poranenia.
Vplyvom slabých agonistov (ADP, PAF, adrenalín, sérotonín, vitronektín, fibronektín atď.) nastupuje expresia fibrinogénových receptorov (GPIIb-IIIa) na membráne krvných doštičiek. Vďaka nim v prítomnosti Ca 2+ iónov fibrinogén viaže na seba 2 blízke krvné doštičky.
V tomto štádiu je agregácia reverzibilná, pretože po agregácii môže nasledovať čiastočná alebo úplná dezintegrácia agregátov - dezagregácia. Navyše, keďže spojenie medzi krvnými doštičkami je krehké, niektoré agregáty sa môžu odlomiť a byť odnesené prietokom krvi. Takáto agregácia sa nazýva primárna alebo reverzibilná. Samozrejme, primárna agregácia nie je schopná zastaviť krvácanie ani z veľmi malých ciev (kapiláry, venuly, arterioly).
Zatiahnutie zrazeniny
Mechanizmus sekundárnej agregácie sprevádzaný sekréciou krvných doštičiek je zložitejší. Na dokončenie hemostázy je potrebné pripojenie množstva ďalších aktivačných mechanizmov so zahrnutím spätnej väzby (reverzná aferentácia v rámci trombocytov). Slabé agonisty vedú k vstupu signálu do krvných doštičiek, v dôsledku čoho sa v nich zvyšuje obsah cytoplazmatického Ca 2+ a dochádza k aktivácii fosfolipázy A2. Ten vedie k uvoľneniu kyseliny arachidónovej z membrány krvných doštičiek, ktorá sa v dôsledku cyklu postupných reakcií mení na mimoriadne aktívne zlúčeniny PgG 2, PgH 2 a tromboxán A 2 (TxA 2), ktoré sú obe silné agonista agregácie a vazokonstriktor.
PgG2, PgH2 a najmä TxA2, ktoré sa uvoľňujú z krvných doštičiek, uskutočňujú takzvané prvé pozitívne spojenie, ktoré spočíva v zosilnení expresie fibrinogénových receptorov a tiež v zosilnení signálu prenášaného vo vnútri krvných doštičiek. Súčasne TxA 2 spôsobuje uvoľňovanie iónov Ca 2+ z hustého tubulárneho systému do cytoplazmy, čo prispieva k rozvoju konečných enzymatických reakcií hemostatických systémov v samotnej doštičke. Tieto reakcie zahŕňajú predovšetkým aktiváciu aktomyozínového systému, ako aj fosforyláciu proteínov. Táto dráha, ktorá začala aktiváciou fosfolipázy C, končí aktiváciou proteínkinázy C s tvorbou inozyltrifosfátu, ktorý je podobne ako TxA2 schopný zvyšovať hladinu Ca2+.
Komplex týchto reakcií vedie v konečnom dôsledku k zníženiu aktomyozínu (trombostenínu) v krvných doštičkách, čo je sprevádzané zvýšením vnútrobunkového tlaku, čo vedie k sekrečným reakciám (reakcia uvoľňovania) a redukcii zátky krvných doštičiek. Zároveň sa doštičky sťahujú k sebe, doštičková zátka sa nielen zmenšuje, ale aj zhrubne, t.j. dochádza k stiahnutiu.
Z krvných doštičiek, ktoré prešli adhéziou a agregáciou, sa intenzívne vylučujú granule a v nich obsiahnuté biologicky aktívne produkty - ADP, PAF, adrenalín, norepinefrín, faktor P4, TxA 2, fibrinogén, vWF, trombospondín, fibronektín, vitronektín a mnohé ďalšie. To všetko výrazne spevňuje doštičkový trombus (obr. 1).
Ryža. jeden. Zloženie granúl krvných doštičiek a ich uvoľňovanie pod vplyvom stimulátorov agregácie.
Treba si uvedomiť, že z krvných doštičiek sa pri uvoľňovacej reakcii uvoľňuje rastový faktor, alebo inak mitogénny faktor, ktorý zohráva dôležitú úlohu v procese opravy poškodených cievnych stien a pri patologických stavoch prispieva k rozvoju aterosklerózy. Rekanalizáciu (obnovenie priechodnosti) cievy podporujú lyzozomálne enzýmy vylučované z g-panulov (lyzozómov) (obr. 2).
Ryža. 2. Produkty sekrécie krvných doštičiek pri fyziologických a patologických reakciách organizmu (podľa A.S. Shitikovej)

Súčasne s uvoľňovaním doštičkových faktorov sa tvorí trombín, ktorý prudko zvyšuje agregáciu a vedie k vzniku fibrínovej siete, v ktorej uviaznu jednotlivé erytrocyty a leukocyty.
Dôležité!!! Za normálnych podmienok zastavenie krvácania z malých ciev trvá od 2 do 4 minút.
Všeobecná schéma vaskulárno-doštičkovej hemostázy
Ryža. 3. Schéma vaskulárno-doštičkovej hemostázy. Symboly: ADP - adenozíndifosfát, GP - glykoproteíny, KA - katecholamíny vWF - Willibrandov faktor

Úloha prostaglandínov pri vaskulárnej hemostáze krvných doštičiek
Mimoriadne dôležitú úlohu v regulácii vaskulárno-doštičkovej hemostázy zohrávajú deriváty kyseliny arachidónovej - prostaglandín I 2 (PgI 2), prípadne prostacyklín a TxA 2.
PgI 2 je tvorený endotelovými bunkami pod vplyvom enzýmu prostacyklínsyntetázy. Za fyziologických podmienok prevažuje pôsobenie PgI 2 nad TxA 2 - silným agregačným činidlom krvných doštičiek. Preto v obehu zdravý človek agregácia krvných doštičiek je obmedzená.
Pri poškodení endotelu v mieste poranenia je narušená tvorba PgI 2, v dôsledku čoho začína prevládať pôsobenie TxA 2 a vytvárajú sa priaznivé podmienky pre agregáciu trombocytov.
Podobný obraz sa pozoruje pri ochoreniach sprevádzaných poškodením cievnej steny (endotelióza). V týchto prípadoch sa na miestach poškodenia ciev tvoria takzvané biele krvné zrazeniny, pozostávajúce najmä z krvných doštičiek. Prítomnosť lokálneho poškodenia koronárnych ciev je jednou z hlavných príčin anginy pectoris, infarktu myokardu v dôsledku reverzibilného (angina pectoris) a ireverzibilného (srdcový infarkt) agregácie krvných doštičiek, po ktorej nasleduje cementácia zátky krvných doštičiek fibrínovými vláknami.
Ryža. 4. Schéma odrážajúca účasť prostaglandínov na regulácii funkcie krvných doštičiek

proces zrážania krvi
Pri poškodení veľkých ciev (tepny, žily) sa vytvorí aj trombocytová zátka, ktorá však nedokáže zastaviť krvácanie, pretože sa prúdom krvi ľahko vyplaví. Hlavný význam v tomto procese má zrážanie krvi, ktoré je v konečnom dôsledku sprevádzané tvorbou hustej fibrínovej zrazeniny.
Teraz sa zistilo, že zrážanie krvi je enzymatický proces. Treba však poznamenať, že zakladateľom enzymatickej teórie zrážania krvi je domáci vedec, profesor na Dorpatskej univerzite A. A. Schmidt, ktorý v rokoch 1861 až 1895 publikoval množstvo prác o mechanizmoch tvorby fibrínových zrazenín. Túto teóriu podporil nemecký vedec R. Morawitz až začiatkom 20. storočia a dočkala sa všeobecného uznania.
Na zrážaní krvi sa podieľa komplex bielkovín v plazme (plazmatické hemokoagulačné faktory), z ktorých väčšina sú proenzýmy. Na rozdiel od doštičkových faktorov sa označujú rímskymi číslicami (faktor I, II atď.).
K aktivácii plazmatických faktorov dochádza najmä v dôsledku proteolýzy a je sprevádzaná štiepením peptidových inhibítorov. Na označenie tohto procesu je k číslu faktora pripojené písmeno „a“ (faktor IIa, Va, VIIa atď.).
Faktory plazmy sú rozdelené do dvoch skupín: závislé od vitamínu K, ktoré sa tvoria najmä v pečeni za účasti vitamínu K, a nezávislé od vitamínu K, na syntézu ktorých vitamín K nie je potrebný. Takéto rozdelenie je pre kliniku mimoriadne výhodné, pretože v prípade hrozieb intravaskulárnej trombózy môže lekár použiť lieky narúšajú syntézu faktorov závislých od vitamínu K a výrazne znižujú riziko trombózy (tabuľka 1).
Stôl 1. Faktory zrážania plazmy
|
Faktor |
Názov faktora |
Vlastnosti a funkcie |
| ja | fibrinogén | Proteín-glykoproteín. Vzniká v pečeni. Pod vplyvom trombínu prechádza do fibrínu. Podieľa sa na agregácii krvných doštičiek. Potrebné na opravu tkaniva. |
| II | protrombín | Proteín-glykoproteín. Neaktívna forma enzýmu trombín. Pod vplyvom protrombinázy prechádza na trombín (faktor IIa). Syntetizovaný v pečeni za účasti vitamínu K. |
| III | tromboplastín | Pozostáva z proteínu apoproteínu III a komplexu fosfolipidov. Je súčasťou membrán mnohých tkanív. Ide o matricu pre nasadenie reakcií zameraných na tvorbu protrombinázy vonkajším mechanizmom. |
| IV | Vápnik | Podieľa sa na tvorbe komplexov, ktoré sú súčasťou tenázy a protrombinázy. Nevyhnutné pre agregáciu krvných doštičiek, uvoľňovaciu reakciu, stiahnutie. |
| V | proakcelerín, Ac-globulín |
Vzniká v pečeni. Nezávislé od vitamínu K. Aktivovaný trombínom. Je súčasťou protrombinázového komplexu. |
| VI | Accelerin | Zvyšuje premenu protrombínu na trombín. |
| VII | Proconvertin | Syntetizuje sa v pečeni za účasti vitamínu K. Vonkajším mechanizmom sa podieľa na tvorbe protrombinázy. Aktivuje sa pri interakcii s tromboplastínom a faktormi XIIa, Xa, IXa, IIa. |
| VIIIC | Antihemofilný globulín A (AHG) | komplexný glykoproteín. Miesto syntézy nebolo presne určené. V plazme tvorí komplex s vWF a špecifickým antigénom. Aktivovaný trombínom. Je súčasťou genázového komplexu. Pri jeho absencii resp prudký pokles vzniká hemofília A. |
| IX | antihemofilný globulín B, Vianočný faktor |
Beta-globulín vzniká v pečeni za účasti vitamínu K. Aktivuje ho trombín a faktor VIIa. Konvertuje faktor X na Xa. Pri jeho absencii alebo prudkom poklese vzniká hemofília B. |
| X | trombotropín, Stuartov-Prowerov faktor |
Glykoproteín produkovaný v pečeni za účasti vitamínu K. Faktor Xa je hlavnou súčasťou protrombinázového komplexu. Aktivovaný faktormi VIIa a IXa. Konvertuje faktor II na IIa. |
| XI | Plazmatický prekurzor tromboplastínu, Rosenthalov faktor |
Glykoproteín. Aktivuje sa faktorom XIIa, kalikreínom, spolu s kininogénom s vysokou molekulovou hmotnosťou (HMW). |
| XII | faktor aktivácie kontaktu, Hagemanov faktor |
Proteín. Aktivovaný negatívne nabitými povrchmi, adrenalínom, kalikreínom. Spúšťa vonkajší a vnútorný mechanizmus tvorby protrombinázy a fibrinolýzy, aktivuje faktor XI a prekalikreín. |
| XIII | fibrínový stabilizačný faktor (FSF), fibrinázy |
Globulín. Syntetizované fibroblastmi a megakaryocytmi. Stabilizuje fibrín. Nevyhnutné pre normálny priebeh reparačných procesov. |
| Faktor Fletcher, plazmatický prekalikreín |
Proteín. Aktivuje faktory XII, plazminogén a VMK. | |
| Fitzgeraldov faktor, kininogén s vysokou molekulovou hmotnosťou (HMW) |
Je aktivovaný kalikreínom, podieľa sa na aktivácii faktora XII, XI a fibrinolýze. | |
| Willebrandov faktor | Zložka faktora VIII, produkovaná v endoteli, v krvnom obehu, spojená s koagulačnou časťou, tvorí polyocénny faktor VIII (antihemofilný globulín A). |
faktory zrážanlivosti erytrocytov
V erytrocytoch sa našlo množstvo zlúčenín podobných doštičkovým faktorom. Najdôležitejší z nich je parciálny tromboplastín, čiže fosfolipidový faktor (pripomínajúci faktor P 3), ktorý je súčasťou membrány. Okrem toho erytrocyty obsahujú antiheparínový faktor, veľké množstvo ADP, fibrinázu a ďalšie zlúčeniny súvisiace s hemostázou. Pri poranení cievy sa zničí asi 1 % najmenej odolných erytrocytov vytekajúcej krvi, čo prispieva k tvorbe trombocytovej zátky a fibrínovej zrazeniny.
Úloha erytrocytov pri zrážaní krvi počas ich hromadného ničenia je obzvlášť veľká, čo sa pozoruje pri transfúzii inkompatibilnej krvi, Rhesusovom konflikte medzi matkou a plodom a hemolytickej anémii.
Leukocytové koagulačné faktory
Leukocyty obsahujú faktory zrážanlivosti, nazývané leukocyty. Najmä monocyty a makrofágy pri stimulácii AG syntetizujú proteínovú časť tromboplastínu – apoproteín III (tkanivový faktor), ktorý výrazne urýchľuje zrážanie krvi. Tie isté bunky sú producentmi koagulačných faktorov závislých od vitamínu K – IX, VII a X. Tieto skutočnosti sú jednou z hlavných príčin diseminovanej (bežnej) intravaskulárnej koagulácie (alebo DIC) pri mnohých zápalových a infekčné choroby, čo značne zhoršuje tok patologický proces a niekedy spôsobiť smrť pacientov.
Tkanivové koagulačné faktory
Dôležitú úlohu v procese zrážania krvi zohrávajú tkanivové faktory, medzi ktoré patrí predovšetkým tromboplastín (faktor III, tkanivový faktor - TF). TF pozostáva z proteínovej časti – apoproteínu III a komplexu fosfolipidov – a často ide o fragment bunkových membrán. Väčšina TF je vystavená zvonku a zahŕňa 2 štrukturálne domény. Keď je tkanivo zničené alebo endotel je stimulovaný endotoxínom a prozápalovými cytokínmi, TF je schopný vstúpiť do krvného obehu a spôsobiť rozvoj DIC.
Mechanizmus zrážania krvi
Proces zrážania krvi je enzymatická kaskáda, v ktorej proenzýmy prechádzajúce do aktívneho stavu (serínové proteinázy) sú schopné aktivovať ďalšie faktory zrážanlivosti krvi. Takáto aktivácia môže byť sekvenčná a retrográdna. V tomto prípade sa aktivácia koagulačných faktorov uskutočňuje v dôsledku proteolýzy, čo vedie k preskupeniu molekúl a štiepeniu peptidov, ktoré majú slabý antikoagulačný účinok.
Proces zrážania krvi možno rozdeliť do 3 fáz
- komplex sekvenčných reakcií vedúcich k tvorbe protrombinázy;
- prechod protrombínu na trombín (faktor II na faktor IIa);
- fibrínová zrazenina vzniká z fibrinogénu.
Tvorba protrombinázy
Tvorba protrombinázy sa môže uskutočňovať vonkajším a vnútorným mechanizmom. Vonkajší mechanizmus zahŕňa povinnú prítomnosť tromboplastínu (TF alebo F-III), zatiaľ čo vnútorný je spojený s účasťou krvných doštičiek (parciálny tromboplastín alebo faktor P 3). Vnútorné a vonkajšie cesty tvorby protrombinázy majú zároveň veľa spoločného, pretože sú aktivované rovnakými faktormi (faktor XIIa, kalikreín, VMK atď.), V konečnom dôsledku tiež vedú k vzniku rovnakých aktívny enzým - faktor Xa , ktorý vykonáva protrombinázové funkcie v kombinácii s faktorom Va. Úplný aj čiastočný tromboplastín zároveň slúži ako matrica, na ktorej sa odvíja cyklus enzymatických reakcií.
Dôležitú úlohu v procese zrážania krvi zohrávajú glycerofosfolipidy a najmä fosfatidylserín a fosfatidyletanolamín v membránovej dvojvrstve. Jednou z vlastností dvojvrstvy je jej asymetria. Fosfatidylcholín a sfingomyelín prevládajú vo vonkajšom cípe dvojvrstvovej membrány kontrahujúcej sa krvou. Ako je známe, tieto fosfolipidy obsahujú fosfocholín, ktorý poskytuje membránovú atrombogenicitu. Molekula týchto fosfolipidov je elektricky neutrálna – neprevažuje v nej jeden z nábojov.
Fosfatidylserín a fosfatidyletanolamín sa nachádzajú prevažne vo vnútornej vrstve membrány. Hlava týchto fosfolipidov nesie dva negatívne náboje a jeden pozitívny náboj, t.j. má záporný náboj. K iniciácii zrážania krvi môže dôjsť len vtedy, keď sa tieto fosfolipidy objavia na vonkajšom povrchu membrány.
Z vyššie uvedeného vyplýva, že na spustenie zrážania krvi je potrebné prelomiť počiatočnú asymetriu membránových fosfolipidov, ku ktorej môže dôjsť iba výmenou fosfolipidov medzi vrstvami, alebo inak povedané, klopným obvodom. Ako sa to stane, keď je poškodená krvná cieva?
Už sme si všimli, že iónová asymetria existuje na oboch stranách membrány. Pre proces zrážania krvi je veľmi dôležitá asymetria v obsahu iónov Ca 2+, ktorých koncentrácia v plazme a intersticiálnej tekutine je desaťtisíckrát väčšia ako v cytoplazme bunky a krvných doštičiek. Akonáhle dôjde k poraneniu cievnej steny, významné množstvo iónov Ca 2+ prechádza do cytoplazmy z extracelulárnej tekutiny alebo z intracelulárneho depa. Vstup Ca 2+ do doštičky alebo buniek (poškodený endotel a pod.) uvoľňuje membránu a zapína mechanizmy udržiavania asymetrie fosfolipidovej dvojvrstvy. V tomto prípade molekuly fosfatidylserínu a fosfatidyletanolamínu, nesúce celkový záporný náboj, prechádzajú na povrch membrány.
Prečo je narušená asymetria v obsahu jednotlivých fosfolipidov vo vonkajšej a vnútornej vrstve membrány? Nedávno sa objavilo množstvo správ, že energeticky závislý proces koncentrácie aminofosfolipidov hlavne vo vnútornom cípe membrány je spojený s fungovaním špecifických synergicky pôsobiacich transmembránových nosných proteínov – translokáz.
Aminofosfolipidové translokázy vykonávajú jednosmerný pohyb fosfatidylserínu a fosfatidyletanolamínu do vnútorného listu membrány. Pri aktivácii buniek, vrátane krvných doštičiek, pri zvýšení hladiny cytoplazmatického Ca2+, pri znížení koncentrácie ATP a pri množstve ďalších posunov dochádza k inhibícii translokáz. V tomto prípade dochádza k obojsmernému transmembránovému pohybu všetkých membránových fosfolipidov, čo vedie k výraznému vyrovnaniu ich koncentrácie v oboch listoch membrány.
No akonáhle sa na povrchu bunkovej membrány zvýši koncentrácia negatívne nabitých fosfolipidov a tie sa dostanú do kontaktu s krvou obsahujúcou obrovskú koncentráciu Ca 2 iónov, vytvoria sa zhluky - aktívne zóny, na ktoré sa naviažu zrážacie faktory. V tomto prípade ióny Ca2+ vykonávajú nasledujúce funkcie:
1. Sú nevyhnutné pre konformáciu koagulačných faktorov, po ktorých sú tieto schopné zúčastniť sa enzymatických reakcií hemostázy.
2. Sú to spojovacie mostíky medzi proteínovými zložkami a bunkovými membránami. Tieto reakcie sa uskutočňujú takto: Ca2+ ióny sú na jednej strane pripojené k hlavám fosfatidylserínu a na druhej strane sú kombinované so zvyškami kyseliny g-karboxyglutámovej, ktorá je súčasťou radu krvných koagulačných faktorov (V, VIII, IX atď.). Vplyvom takýchto vápnikových mostíkov dochádza k počiatočnej orientácii krvných koagulačných faktorov na fosfolipidovom povrchu a v dôsledku konformácie proteínových molekúl sa otvárajú aktívne centrá.
Bez iónov Ca 2+ sa nemôžu vytvárať zhluky a enzýmy podieľajúce sa na zrážaní krvi nemôžu navzájom interagovať.
Tvorba protrombinázy pozdĺž vonkajšej dráhy začína aktiváciou faktora VII počas jeho interakcie s tromboplastínom, ako aj s faktormi XIIa, IXa, Xa a kalikreínom. Faktor VIIa zase aktivuje nielen faktor X, ale aj faktor IX. Na procese tvorby protrombinázy sa vonkajším mechanizmom môžu podieľať aj faktory IXa a VIIIa, ktoré tvoria aktívny komplex na fosfolipidovej matrici. Táto reakcia je však pomerne pomalá.
Tvorba protrombinázy pozdĺž vonkajšej dráhy je extrémne rýchla (trvá niekoľko sekúnd) a vedie k objaveniu sa faktora Xa a malých častí trombínu (IIa), ktorý podporuje ireverzibilnú agregáciu krvných doštičiek, aktiváciu faktorov VIII a V a výrazne urýchľuje tvorbu protrombinázy vnútornými a vonkajšími mechanizmami.
Iniciátorom vnútornej dráhy tvorby protrombinázy je faktor XII, ktorý je aktivovaný poraneným povrchom, kožou, kolagénom, adrenalínom, následne premieňa faktor XI na XIa.
Táto reakcia zahŕňa kalikreín (aktivovaný faktorom XIIa) a VMK (aktivovaný kalikreínom).
Faktor XIa má priamy vplyv na faktor IX a premieňa ho na faktor IXa. Jeho špecifická aktivita je zameraná na proteolýzu faktora X (prenáša ho na faktor Xa) a prebieha na povrchu fosfolipidov krvných doštičiek s povinnou účasťou faktora VIII (alebo VIIIa). Komplex faktorov IXa, VIIIa na fosfolipidovom povrchu krvných doštičiek sa nazýva tenáza alebo tenázový komplex.
Ako už bolo uvedené, prekalikreín a VMK sa podieľajú na procese zrážania krvi, vďaka čomu sa (rovnako ako faktor XII) kombinujú vonkajšie a vnútorné cesty zrážania krvi. Teraz sa zistilo, že vaskulárne poškodenie vždy uvoľňuje metaloproteíny, ktoré premieňajú prekalikreín na kalikreín. Pod vplyvom kalikreínu prechádza VMK do VMKa. Okrem toho kalikreín podporuje aktiváciu faktorov VII a XII, čo je tiež sprevádzané spustením kaskádového mechanizmu zrážania krvi.
Konverzia protrombínu na trombín
Druhá fáza procesu zrážania krvi (prechod faktora II na faktor IIa) sa uskutočňuje pod vplyvom protrombinázy (komplex Xa + Va + Ca2+) a redukuje sa na proteolytické štiepenie protrombínu, vďaka čomu sa trombín objaví sa enzým, ktorý má koagulačnú aktivitu.
Konverzia fibrinogénu na fibrín
Tretia etapa procesu zrážania krvi - prechod fibrinogénu na fibrín - zahŕňa 3 etapy. V prvom štádiu sa vplyvom faktora IIa odštiepia 2 fibrínové peptidy A a 2 fibrínové peptidy B z fibrinogénu, čo vedie k tvorbe fibrínových monomérov. V druhom štádiu sa v dôsledku polymerizačného procesu najskôr vytvoria fibrínové diméry a oligoméry, ktoré sa následne transformujú na fibrínové vlákna - protofibrily ľahko rozpustného fibrínu, alebo fibríny (rozpustné), rýchlo lyzujúce pod vplyvom proteáz (plazmín, trypsín). Do procesu tvorby fibrínu zasahuje faktor XIII (fibrináza, fibrín-stabilizujúci faktor), ktorý po aktivácii trombínom v prítomnosti Ca 2+ zosieťuje fibrínové polyméry ďalšími zosieťovaniami, vďaka čomu ťažko rozpustný fibrín, alebo fibrín i (nerozpustný). V dôsledku tejto reakcie sa zrazenina stáva odolnou voči močovine a fibrinolytickým (proteolytickým) činidlám a je ťažké ju rozložiť.
Ryža. päť. Schéma koagulácie krvi. Legenda: tenké šípky – aktivácia, hrubé šípky – prechod faktora do aktívneho stavu, HMK – kininogén s vysokou molekulovou hmotnosťou, I – fibrinogén, Im – monomér fibrínu, Is – vysoko rozpustný fibrín, Ii – ťažko rozpustný fibrín.

Vzniknutá fibrínová zrazenina sa vďaka krvným doštičkám obsiahnutým v jej štruktúre sťahuje a zahusťuje (nastáva retrakcia) a pevne upcháva poškodenú cievu.
Prírodné antikoagulanciá
Napriek tomu, že v obehu sú prítomné všetky faktory potrebné na tvorbu krvnej zrazeniny, za prirodzených podmienok, v prítomnosti neporušených ciev, zostáva krv tekutá. Je to spôsobené prítomnosťou antikoagulancií, nazývaných prírodné antikoagulanciá, v krvnom riečisku a fibrinolytického spojenia hemostatického systému.
Prírodné antikoagulanciá sa delia na primárne a sekundárne. Primárne antikoagulanciá sú vždy prítomné v obehu, sekundárne antikoagulanciá vznikajú v dôsledku proteolytického štiepenia krvných koagulačných faktorov pri tvorbe a rozpúšťaní fibrínovej zrazeniny.
Primárne antikoagulanciá možno rozdeliť do 3 hlavných skupín: 1) s antitromboplastickým a antiprotrombinázovým účinkom (antitromboplastíny); 2) viazanie trombínu (antitrombíny); 3) zabránenie prechodu fibrinogénu na fibrín (inhibítory samousporiadania fibrínu).
Antitromboplastíny primárne zahŕňajú inhibítor vonkajšej dráhy (TFPI). Zistilo sa, že je schopný blokovať komplex faktorov III + VII + Xa, čím bráni tvorbe protrombinázy vonkajším manizmom. Nedávno bol objavený ďalší inhibítor vonkajšej dráhy tvorby protrombinázy, nazývaný TFPI-2 (anexín V), ktorý má však menšiu aktivitu ako TFPI.
Medzi inhibítory, ktoré blokujú tvorbu protrombinázy, patria proteíny C, S závislé od vitamínu K (PrC, PrS) a špeciálny proteín syntetizovaný endotelom, trombomodulín. Pod vplyvom trombomodulínu a s ním spojeného trombínu prechádza PrC do aktívneho stavu (Pra), ktorý je podporovaný kofaktorom PrS, PrCa štiepi faktory V a VIII na polovicu a tým zabraňuje tvorbe protrombinázy vnútornou cestou a prechod protrombínu na trombín.
Nedávno sa objavili správy, že PrS je schopný viazať faktor Xa. Táto reakcia je nezávislá od fosfolipidového povrchu a je zosilnená v prítomnosti PrC.
Jedným z popredných antikoagulancií je proteín antitrombín III (A-III), ktorý má molekulovú hmotnosť (MW) 58 kD. Samotný A-III má slabý antikoagulačný účinok. Zároveň je schopný vytvárať komplex so sulfátovaným polysacharidom glykozaminoglykánom heparínom (G) - A-III + G. Tento komplex viaže faktory IIa, IXa, Xa, Xla, XIIa, kalikreín a plazmín. Existuje heparín s vysokou molekulovou hmotnosťou (nefrakcionovaný) s molekulovou hmotnosťou od 25 do 35 kD a heparín s nízkou molekulovou hmotnosťou s molekulovou hmotnosťou menšou ako 5 kD. Ten potrebuje interakciu s A-III v menšej miere a neutralizuje prevažne faktor Xa, pretože jeho reťazec je malý a „nedosahuje“ trombín. G s nízkou molekulovou hmotnosťou podporuje uvoľňovanie TFPI z endotelu vo väčšej miere ako vysokomolekulárny G, vďaka čomu sa zvyšuje jeho antikoagulačná aktivita. Treba tiež poznamenať, že heparíny s nízkou molekulovou hmotnosťou inhibujú prokoagulačnú aktivitu poškodeného endotelu a niektorých proteáz vylučovaných granulocytmi a makrofágmi (obr. 6).

Nedávno sa objavili správy o prítomnosti ďalšieho antikoagulantu, proteínu antitrombínu II, ale jeho aktivita je nižšia ako aktivita A-III. Dôležitým inhibítorom zrážanlivosti je kofaktor heparínu II, ktorý viaže trombín. Jeho pôsobenie sa mnohonásobne zvyšuje pri interakcii s heparínom.
Inhibítorom trombínu, faktorov IXa, Xla, XIIa a plazmínu je a1-antitrypsín. A2-makroglobulín je slabý inhibítor trombínu, kalikreínu a plazmínu.
Primárne antikoagulanciá by mali zahŕňať aj autoprotilátky proti aktívnym faktorom zrážanlivosti krvi (IIa, Xa atď.), ktoré sú vždy prítomné v krvnom obehu, ako aj receptory, ktoré opustili bunku (tzv. „plávajúce“ receptory) na aktivovanú krv. koagulačné faktory. Ich úloha v normálnych a patologických stavoch je však ešte ďaleko od konečného objasnenia.
Je potrebné poznamenať, že s poklesom koncentrácie primárnych prírodných antikoagulancií sa vytvárajú priaznivé podmienky pre rozvoj trombofílie a diseminovanej intravaskulárnej koagulácie - DIC.
Tabuľka 2 Základné prírodné antikoagulanciá (primárne)
| Antitrombín III | Alfa2 globulín. Syntetizovaný v pečeni. Progresívny inhibítor trombínu, faktorov IXa, Xa, XIa, XIIa, kalikreínu a v menšej miere plazmínu a trypsínu. Plazmatický kofaktor heparínu. |
| heparín | sulfátovaný polysacharid. Transformuje antitrombín III z progresívneho antikoagulancia na okamžitý účinok, čím výrazne zvyšuje jeho aktivitu. Vytvára komplexy s trombogénnymi proteínmi a hormónmi, ktoré majú antikoagulačný a fibrinolytický účinok. |
| Heparínový kofaktor II | Slabý antikoagulačný účinok v prítomnosti heparínu. |
| Alfa2 antiplazmín | Proteín. Inhibuje pôsobenie plazmínu, trypsínu, chemotripsínu, kalikreínu, faktora Xa, urokinázy. |
| Alfa2 makroglobulín | Slabý progresívny inhibítor trombínu, kalikreínu, plazmínu a trypsínu. |
| Alfa1 antitrypsín | Inhibítor trombínu, faktory IXa, Xla, XIIa, trypsín a plazmín. |
| inhibítor C1-esterázy alebo inhibítor komplimentu I | Alfa 1-neuroaminoglykoproteín. Inaktivuje kalikreín, čím zabraňuje jeho pôsobeniu na kininogén, faktory XIIa, IXa, XIa a plazmín. |
| TFPI | Inhibuje komplex TF+VII+Xa. |
| TFPI-2 alebo anexín V | Tvorí sa v placente. Inhibuje komplex TF+VII+Xa. |
| Proteín C | Proteín závislý od vitamínu K. Tvorí sa v pečeni a endoteli. Má vlastnosti serínovej proteázy. Inaktivuje faktory Va a VIIIa a stimuluje fibrinolýzu. |
| Proteín S | Proteín závislý od vitamínu K. Produkované endotelovými bunkami. Zvyšuje pôsobenie proteínu C. |
| trombomodulín | Glykoproteín fixovaný na cytoplazmatickú membránu endotelu. Kofaktor proteínu C sa viaže na faktor IIa a inaktivuje ho. |
| Inhibítor samousporiadania fibrínu | Polypeptid sa tvorí v rôznych tkanivách. Pôsobí na fibrínový monomér a polymér. |
| plávajúce receptory | Faktory viažuce glykoproteíny IIa a Xa a prípadne ďalšie serínové proteázy |
| Autoprotilátky proti aktívnym koagulačným faktorom | Sú v plazme, inhibujú faktory atď. |
Sekundárne antikoagulanciá zahŕňajú „použité“ krvné koagulačné faktory (ktoré sa podieľali na zrážaní) a degradačné produkty fibrinogénu a fibrínu (PDF), ktoré majú antiagregačné a antikoagulačné účinky a tiež stimulujú fibrinolýzu. Úloha sekundárnych antikoagulancií sa redukuje na obmedzenie intravaskulárnej koagulácie a šírenia krvnej zrazeniny cez cievy.
fibrinolýza
Fibrinolýza je neoddeliteľnou súčasťou systému hemostázy, vždy sprevádza proces zrážania krvi a dokonca je aktivovaná rovnakými faktormi (XIIa, kalikreín, VMK atď.). Ako dôležitá ochranná reakcia fibrinolýza zabraňuje upchatiu krvných ciev fibrínovými zrazeninami a vedie aj k rekanalizácii krvných ciev po zastavení krvácania. Zložky fibrinolýzy hrajú dôležitú úlohu pri odstraňovaní extracelulárneho matrixu a okrem toho regulujú rast a delenie buniek, hojenie rán, regeneráciu svalov, rast nádorov a metastázy atď.
Enzýmom degradujúcim fibrín je plazmín (niekedy nazývaný fibrinolyzín), ktorý je v obehu v neaktívnom stave ako proenzým plazminogén. Vplyvom jeho aktivátorov dochádza k štiepeniu Arg561-Val562 peptidovej väzby plazminogénu, čo vedie k tvorbe plazmínu. Aktívne centrum plazmínu sa nachádza v ľahkom reťazci, čo je nízkošpecifická proteáza schopná štiepiť takmer všetky plazmatické proteíny.
V krvnom obehu sa plazminogén vyskytuje v dvoch hlavných formách: vo forme natívneho proenzýmu s NH2-koncovou kyselinou glutámovou – glu-plazminogénom a vo forme čiastočne proteolyzovaného – lys-plazminogénu. Ten je približne 20-krát rýchlejšie transformovaný fyziologickými aktivátormi na plazmín a má tiež väčšiu afinitu k fibrínu.
Fibrinolýza, podobne ako proces zrážania krvi, môže prebiehať vonkajšími a vnútornými cestami.
Externá dráha aktivácie plazminogénu
Vonkajšia dráha aktivácie plazminogénu sa uskutočňuje za účasti tkanivových aktivátorov, ktoré sa syntetizujú hlavne v endoteli. Medzi ne patrí predovšetkým aktivátor tkanivového plazminogénu (TPA).
Okrem toho je aktivátorom plazminogénu urokináza, ktorá sa tvorí v obličkách (v juxtaglomerulárnom aparáte), ako aj vo fibroblastoch, epitelových bunkách, pneumocytoch, deceduálnych bunkách placenty a endoteliocytoch. Mnohé bunky obsahujú receptory pre urokinázu, čo bol dôvod považovať ju za hlavný aktivátor fibrinolýzy v medzibunkovom priestore, ktorý zabezpečuje proteolýzu počas bunkového rastu, bunkového delenia a migrácie.
Podľa Z.S. Na vonkajšej dráhe aktivácie fibrinolýzy sa podieľajú aj Barkagan, aktivátory krvných buniek - leukocytov, krvných doštičiek a erytrocytov.
Vnútorná aktivačná dráha pre fibrinolýzu
Vnútorná dráha aktivácie fibrinolýzy, uskutočňovaná aktivátormi plazmy, sa delí na Hageman-dependentnú a Hageman-independentnú.
Hageman-dependentná fibrinolýza vykonaná najrýchlejšie a je naliehavá. Jeho hlavným účelom je vyčistiť cievne lôžko od fibrínových zrazenín vytvorených v procese intravaskulárnej koagulácie krvi. Hageman-dependentná fibrinolýza sa vyskytuje pod vplyvom faktorov XIIa, kalikreínu a VMK, ktoré premieňajú plazminogén na plazmín.
Hagemannova nezávislá fibrinolýza sa môže uskutočniť pod vplyvom proteínov C a S (obr. 7).
Ryža. 7. Schéma fibrinolýzy.

Plazmín vytvorený ako výsledok aktivácie spôsobuje štiepenie fibrínu. V tomto prípade sa objavujú skoré (s veľkou molekulovou hmotnosťou) a neskoré (nízka molekulová hmotnosť) produkty degradácie fibrínu alebo FDP.
inhibítory fibrinolýzy
Až 90 % všetkej antifibrinolytickej aktivity je sústredených v doštičkových α-granulách, ktoré sa pri ich aktivácii uvoľňujú do krvného obehu. V plazme sú tiež inhibítory fibrinolýzy. V súčasnosti boli identifikované 4 typy aktivátorov plazminogénu a inhibítorov urokinázy.
Najdôležitejším z nich je inhibítor typu 1 (PAI-1), ktorý sa často označuje ako endoteliálny. Zároveň je syntetizovaný nielen endotelom, ale aj hepatocytmi, monocytmi, makrofágmi, fibroblastmi a svalovými bunkami. Krvné doštičky, ktoré sa hromadia v miestach poškodenia endotelu, tiež uvoľňujú PAI-1. PAI-1 je inhibítor serínovej proteázy. Jeho zvláštnosť spočíva v tom, že prechod z neaktívnej na aktívnu formu sa uskutočňuje bez čiastočnej proteolýzy (v dôsledku konformácie molekuly) a ide o reverzibilný proces. Aj keď je koncentrácia PAI-1 asi 1000-krát nižšia ako u iných inhibítorov proteázy, hrá hlavnú úlohu v regulácii počiatočné štádiá fibrinolýza.
Najdôležitejším inhibítorom fibrinolýzy je a2-antiplazmín, ktorý viaže nielen plazmín, ale aj trypsín, kalikreín, urokinázu, TAP, a preto interferuje tak na začiatku, ako aj na začiatku. neskoré štádiá fibrinolýza.
Silným inhibítorom plazmínu je inhibítor al-proteázy (al-antitrypsín).
Okrem toho je fibrinolýza inhibovaná a2-makroglobulínom, inhibítorom C1-esterázy a množstvom inhibítorov aktivátora plazminogénu syntetizovaných endotelom, makrofágmi, monocytmi a fibroblastmi.
Fibrinolytická aktivita krvi je do značnej miery určená pomerom aktivátorov a inhibítorov fibrinolýzy.
So zrýchlením zrážania krvi a súčasnou inhibíciou fibrinolýzy sa vytvárajú priaznivé podmienky pre rozvoj trombózy, embólie a DIC.
Spolu s enzymatickou fibrinolýzou sa podľa profesora B.A. Kudrjašova a jeho študentov dochádza k takzvanej neenzymatickej fibrinolýze, ktorá je spôsobená komplexnými zlúčeninami prírodného antikoagulantu heparínu s enzýmami a hormónmi. Neenzymatická fibrinolýza vedie k rozkladu nestabilizovaného fibrínu, čím sa cievne riečisko čistí od fibrínových monomérov a fibrínov.
Štyri úrovne regulácie hemostázy krvných doštičiek, zrážania krvi a fibrinolýzy
Koagulácia krvi pri kontakte so sklom, poraneným povrchom alebo pokožkou sa uskutoční za 5-10 minút. Hlavný čas v tomto procese sa vynakladá na tvorbu protrombinázy, zatiaľ čo prechod protrombínu na trombín a fibrinogénu na fibrín sa uskutočňuje pomerne rýchlo. V prirodzených podmienkach sa čas zrážania krvi môže znížiť (vyvinie sa hyperkoagulácia) alebo predĺžiť (dochádza k hypokoagulácii).
Medzitým sa tvorba zátky krvných doštičiek a zastavenie krvácania z malých ciev uskutoční v priebehu 2-4 minút.
Molekulárna úroveň regulácie
Molekulárna - zahŕňa udržiavanie homeostatickej rovnováhy jednotlivých faktorov, ktoré ovplyvňujú vaskulárno-doštičkovú hemostázu, zrážanlivosť krvi a fibrinolýzu. V tomto prípade je potrebné čo najskôr odstrániť prebytok faktora, ktorý sa vyskytuje z jedného alebo druhého dôvodu v tele. Táto rovnováha sa neustále udržiava medzi prostacyklínom (Pgl2) a TxA2, prokoagulantmi a antikoagulanciami, aktivátormi plazminogénu a inhibítormi.
Prítomnosť bunkových receptorov pre mnohé faktory zrážania krvi a fibrinolýzy je základom homeostatickej rovnováhy v systéme hemostázy na molekulárnej úrovni. Receptory pre koagulačné a fibrinolytické faktory, ktoré sa oddeľujú od bunky („plávajúce“ receptory) získavajú nové vlastnosti, stávajú sa prirodzenými antikoagulanciami, inhibítormi plazmínu a aktivátorom plazminogénu.
Môže sa vykonávať molekulárna úroveň regulácie imunitný systém za pomoci tvorby protilátok proti aktivovaným faktorom zrážania krvi a fibrinolýze - IIa, Xa, TAP a i.
Treba tiež pamätať na to, že existuje genetická kontrola nad produkciou faktorov, ktoré zabezpečujú tvorbu a rozpúšťanie krvnej zrazeniny.
Bunková úroveň regulácie
V krvnom obehu dochádza k neustálej spotrebe koagulačných a fibrinolýznych faktorov, čo by malo nevyhnutne viesť k obnoveniu ich koncentrácie. Tento proces musí byť podmienený resp aktivované faktory alebo (pravdepodobnejšie) produkty ich rozkladu. Ak je to tak, potom bunky produkujúce faktory koagulácie a fibrinolýzy musia niesť receptory pre tieto zlúčeniny alebo ich usadeniny. Takéto receptory sa našli na mnohých bunkách pre trombín, kalikreín, aktivátor plazminogénu, plazmín, streptokinázu, PDF a mnohé ďalšie. Bunková regulácia by sa mala vykonávať podľa mechanizmu spätnej väzby (reverzná aferentácia). Bunková úroveň regulácie hemostatických systémov je čiastočne zabezpečená „parietálnou“ fibrinolýzou, ku ktorej dochádza, keď sa fibrín ukladá na endoteli cievnej steny.
Orgánová úroveň regulácie
Orgánová úroveň regulácie poskytuje optimálne podmienky pre fungovanie systému hemostázy v rôznych častiach cievneho riečiska. V dôsledku tejto úrovne sa prejavuje mozaikový obraz vaskulárno-doštičkovej hemostázy, zrážania krvi a fibrinolýzy.
Neuro-humorálna regulácia
Neurohumorálna regulácia riadi stav systému hemostázy od molekulárnej až po orgánovú úroveň, pričom zabezpečuje integritu reakcie na úrovni tela, najmä prostredníctvom sympatického a parasympatického oddelenia autonómnych orgánov. nervových systémov s, ako aj hormóny a rôzne biologicky aktívne zlúčeniny.
Zistilo sa, že pri akútnej strate krvi, hypoxii, intenzívnej svalovej práci, podráždení bolesti, strese sa koagulácia krvi výrazne zrýchli, čo môže viesť k objaveniu sa monomérov fibrínu a dokonca fibrínu v cievnom riečisku. Avšak v dôsledku súčasnej aktivácie fibrinolýzy, ktorá má ochranný charakter, sa vznikajúce fibrínové zrazeniny rýchlo rozpúšťajú a nepoškodzujú zdravé telo.
Zrýchlenie zrážania krvi a zvýšená fibrinolýza pri všetkých týchto stavoch je spojená so zvýšením tonusu sympatického oddelenia autonómneho nervového systému a vstupom adrenalínu a norepinefrínu do krvného obehu. Súčasne sa aktivuje Hagemanov faktor, čo vedie k spusteniu vonkajšieho a vnútorného mechanizmu tvorby protrombinázy, ako aj stimulácii Hageman-dependentnej fibrinolýzy. Okrem toho sa pod vplyvom adrenalínu zvyšuje tvorba apoproteínu III, integrálnej súčasti tromboplastínu, a bunkové membrány s vlastnosťami tromboplastínu sa oddeľujú od endotelu, čo prispieva k prudkému zrýchleniu zrážania krvi. TAP a urokináza sa tiež uvoľňujú z endotelu, čo vedie k stimulácii fibrinolýzy.
So zvýšením tonusu parasympatického oddelenia autonómneho nervového systému (podráždenie vagusového nervu, zavedenie acetylcholínu, pilokarpínu) dochádza aj k zrýchleniu zrážania krvi a stimulácii fibrinolýzy. Aj keď sa to na prvý pohľad môže zdať zvláštne, aj za týchto podmienok sa z endotelu srdca a krvných ciev uvoľňujú aktivátory tromboplastínu a plazminogénu.
Ukázalo sa, že vazokonstrikčné aj vazodilatačné účinky spôsobujú rovnaký typ účinku na strane zrážania krvi a fibrinolýzy – uvoľňovanie tkanivového faktora a TAP. Preto je hlavným eferentným regulátorom zrážania krvi a fibrinolýzy cievna stena. Pripomíname tiež, že Pgl2 sa syntetizuje vo vaskulárnom endoteli, čo zabraňuje adhézii a agregácii krvných doštičiek v krvnom riečisku.
Zároveň môže byť rozvíjajúca sa hyperkoagulácia nahradená hypokoaguláciou, ktorá je v prirodzených podmienkach sekundárna a je spôsobená spotrebou (spotrebou) krvných doštičiek a plazmatických koagulačných faktorov, tvorbou sekundárnych antikoagulancií, ako aj reflexným uvoľňovaním heparínu resp. A-III do cievneho riečiska v reakcii na objavenie sa trombínu.
Dôležité!!! Je potrebné poznamenať, že existuje kortikálna regulácia systému hemostázy, čo brilantne dokázali školy profesora E.S. Ivanitsky-Vasilenko a akademik A.A. Markosjan. V týchto laboratóriách boli vyvinuté podmienené reflexy na urýchlenie aj spomalenie zrážania krvi.
zrážanie krvi
Koagulácia krvi je najdôležitejšou etapou v práci systému hemostázy, ktorý je zodpovedný za zastavenie krvácania v prípade poškodenia cievneho systému tela. Koagulácii krvi predchádza štádium primárnej vaskulárno-doštičkovej hemostázy. Táto primárna hemostáza je takmer úplne spôsobená vazokonstrikciou a mechanickým blokovaním agregátov krvných doštičiek v mieste poškodenia cievnej steny. charakteristický čas na primárnu hemostázu u zdravého človeka je 1-3 minúty. Koagulácia krvi (hemokoagulácia, koagulácia, plazmatická hemostáza, sekundárna hemostáza) je komplexný biologický proces tvorby fibrínových proteínových vlákien v krvi, ktoré polymerizujú a tvoria krvné zrazeniny, v dôsledku čoho krv stráca svoju tekutosť a získava zrazenú konzistenciu. . Zrážanie krvi u zdravého človeka sa vyskytuje lokálne, v mieste tvorby primárnej trombocytovej zátky. Charakteristický čas tvorby fibrínovej zrazeniny je asi 10 minút.
Fyziológia
Fibrínová zrazenina získaná pridaním trombínu do plnej krvi. Skenovacia elektrónová mikroskopia.
Proces hemostázy sa redukuje na tvorbu trombocytovej fibrínovej zrazeniny. Bežne sa delí na tri stupne:
- Dočasný (primárny) vazospazmus;
- Tvorba zátky krvných doštičiek v dôsledku adhézie a agregácie krvných doštičiek;
- Zatiahnutie (redukcia a zhutnenie) zátky krvných doštičiek.
Poranenie ciev je sprevádzané okamžitou aktiváciou krvných doštičiek. Adhézia (lepenie) krvných doštičiek na vlákna spojivové tkanivo na okrajoch rany je spôsobený glykoproteínovým von Willebrandovým faktorom. Súčasne s adhéziou dochádza k agregácii krvných doštičiek: aktivované krvné doštičky sa pripájajú k poškodeným tkanivám a k sebe navzájom a vytvárajú agregáty, ktoré blokujú cestu straty krvi. Objaví sa zátka krvných doštičiek
Z krvných doštičiek, ktoré prešli adhéziou a agregáciou, sa intenzívne vylučujú rôzne biologicky aktívne látky. účinných látok(ADP, epinefrín, norepinefrín atď.), ktoré vedú k sekundárnej, ireverzibilnej agregácii. Súčasne s uvoľňovaním doštičkových faktorov vzniká trombín, ktorý pôsobí na fibrinogén a vytvára fibrínovú sieť, v ktorej uviaznu jednotlivé erytrocyty a leukocyty - vzniká takzvaná trombocytovo-fibrínová zrazenina (doštičková zátka). Vďaka kontraktilnému proteínu trombostenínu sa krvné doštičky sťahujú k sebe, doštičková zátka sa sťahuje a zahusťuje a dochádza k jej stiahnutiu.
proces zrážania krvi

Klasická schéma zrážania krvi podľa Moravitsa (1905)
Proces zrážania krvi je prevažne proenzýmovo-enzýmová kaskáda, v ktorej proenzýmy prechádzajú do aktívneho stavu a získavajú schopnosť aktivovať ďalšie faktory zrážanlivosti krvi. V najjednoduchšej forme možno proces zrážania krvi rozdeliť do troch fáz:
- aktivačná fáza zahŕňa komplex po sebe nasledujúcich reakcií vedúcich k tvorbe protrombinázy a prechodu protrombínu na trombín;
- koagulačná fáza - tvorba fibrínu z fibrinogénu;
- retrakčná fáza - tvorba hustej fibrínovej zrazeniny.
Táto schéma bola opísaná v roku 1905 Moravitsom a dodnes nestratila svoj význam.
Od roku 1905 sa dosiahol značný pokrok v oblasti podrobného pochopenia procesu zrážania krvi. Boli objavené desiatky nových proteínov a reakcií zapojených do kaskádového procesu zrážania krvi. Zložitosť tohto systému je spôsobená potrebou regulovať tento proces. Moderné znázornenie kaskády reakcií sprevádzajúcich zrážanie krvi je znázornené na obr. 2 a 3. V dôsledku deštrukcie tkanivových buniek a aktivácie krvných doštičiek sa uvoľňujú fosfolipoproteínové proteíny, ktoré spolu s plazmatickými faktormi X a a V a, ako aj iónmi Ca 2+ tvoria enzýmový komplex, ktorý aktivuje protrombín. Ak sa proces koagulácie začne pôsobením fosfolipoproteínov vylučovaných z buniek poškodených ciev alebo spojivového tkaniva, hovoríme o vonkajší systém zrážania krvi(cesta aktivácie vonkajšieho zrážania alebo dráha tkanivového faktora). Hlavnými zložkami tejto dráhy sú 2 proteíny: faktor VIIa a tkanivový faktor, komplex týchto 2 proteínov sa tiež nazýva vonkajší tenázový komplex.
Ak k iniciácii dôjde pod vplyvom koagulačných faktorov prítomných v plazme, používa sa termín. vnútorný zrážací systém. Komplex faktorov IXa a VIIIa, ktorý sa tvorí na povrchu aktivovaných krvných doštičiek, sa nazýva vnútorná tenáza. Faktor X teda môže byť aktivovaný komplexom VIIa-TF (externá tenáza) aj komplexom IXa-VIIIa (vnútorná tenáza). Vonkajšie a vnútorné systémy zrážania krvi sa navzájom dopĺňajú.
V procese adhézie sa tvar krvných doštičiek mení - stávajú sa zaoblenými bunkami s ostnatými výbežkami. Pod vplyvom ADP (čiastočne uvoľneného z poškodených buniek) a adrenalínu sa zvyšuje schopnosť krvných doštičiek agregovať. Zároveň sa z nich uvoľňuje sérotonín, katecholamíny a množstvo ďalších látok. Pod ich vplyvom sa lúmen poškodených ciev zužuje, dochádza k funkčnej ischémii. Cievy sú nakoniec okludované masou krvných doštičiek priľnutých k okrajom kolagénových vlákien pozdĺž okrajov rany.
V tomto štádiu hemostázy sa tvorí trombín pôsobením tkanivového tromboplastínu. Je to on, kto iniciuje ireverzibilnú agregáciu krvných doštičiek. Trombín, ktorý reaguje so špecifickými receptormi v membráne krvných doštičiek, spôsobuje fosforyláciu intracelulárnych proteínov a uvoľňovanie iónov Ca2+.
V prítomnosti vápenatých iónov v krvi pôsobením trombínu dochádza k polymerizácii rozpustného fibrinogénu (pozri fibrín) a tvorbe neštruktúrovanej siete vlákien nerozpustného fibrínu. Od tohto momentu sa krvné bunky začnú filtrovať v týchto vláknach, čím sa vytvorí dodatočná tuhosť pre celý systém a po chvíli sa vytvorí trombocytovo-fibrínová zrazenina (fyziologický trombus), ktorá na jednej strane upcháva miesto prasknutia a zabraňuje vzniku krvi strata, a na druhej strane - blokovanie vstupu vonkajších látok a mikroorganizmov do krvi. Zrážanie krvi je ovplyvnené mnohými stavmi. Napríklad katióny urýchľujú proces, zatiaľ čo anióny ho spomaľujú. Okrem toho existujú látky, ktoré zrážanlivosť krvi úplne blokujú (heparín, hirudín atď.) a zároveň ju aktivujú (jed gyurza, feracryl).
Vrodené poruchy systému zrážania krvi sa nazývajú hemofília.
Metódy diagnostiky zrážanlivosti krvi
Celú škálu klinických testov systému zrážania krvi možno rozdeliť do 2 skupín: globálne (integrálne, všeobecné) testy a „lokálne“ (špecifické) testy. Globálne testy charakterizujú výsledok celej kaskády zrážania. Sú vhodné na diagnostiku celkového stavu systému zrážania krvi a závažnosti patológií pri zohľadnení všetkých ovplyvňujúcich faktorov. Globálne metódy zohrávajú kľúčovú úlohu v prvej fáze diagnostiky: poskytujú ucelený obraz o prebiehajúcich zmenách v koagulačnom systéme a umožňujú predpovedať tendenciu k hyper- alebo hypokoagulácii vo všeobecnosti. "Lokálne" testy charakterizujú výsledok práce jednotlivých prepojení v kaskáde systému zrážania krvi, ako aj jednotlivých koagulačných faktorov. Sú nevyhnutné pre možné objasnenie lokalizácie patológie s presnosťou koagulačného faktora. Na získanie úplného obrazu o práci hemostázy u pacienta musí mať lekár možnosť vybrať si, ktorý test potrebuje.
Globálne testy:
- Stanovenie času zrážania plnej krvi (metóda Mas-Magro alebo Morawitzova metóda)
- Test tvorby trombínu (trombínový potenciál, endogénny trombínový potenciál)
"Miestne" testy:
- Aktivovaný parciálny tromboplastínový čas (APTT)
- Test protrombínového času (alebo protrombínový test, INR, PT)
- Vysoko špecializované metódy na zisťovanie zmien koncentrácie jednotlivých faktorov
Všetky metódy, ktoré merajú časový interval od momentu pridania činidla (aktivátora, ktorý spúšťa proces zrážania) po vytvorenie fibrínovej zrazeniny v skúmanej plazme, sú zrážacie metódy (z anglického „clot“ - zrazenina).
pozri tiež
Poznámky
Odkazy
Nadácia Wikimedia. 2010.
- Baseball na Letných olympijských hrách 1996
Koagulácia krvi- premena tekutej krvi na elastickú zrazeninu v dôsledku prechodu fibrinogénu rozpusteného v krvnej plazme na nerozpustný fibrín; ochranná reakcia zvierat a ľudí, ktorá zabraňuje strate krvi v prípade porušenia integrity krvných ciev ... Biologický encyklopedický slovník
zrážanie krvi- — Témy biotechnológie EN zrážanie krvi … Technická príručka prekladateľa
zrážanie krvi encyklopedický slovník
Koagulácia krvi- zrážanie krvi, prechod krvi z tekutého stavu do želatínovej zrazeniny. Táto vlastnosť krvi (zrážanie) je ochrannou reakciou, ktorá zabraňuje strate krvi v tele. S. to. prebieha ako sled biochemických reakcií, ... ... Veterinárny encyklopedický slovník
Koagulácia krvi- premena tekutej krvi na elastickú zrazeninu v dôsledku premeny proteínu fibrinogénu rozpusteného v krvnej plazme na nerozpustný fibrín, keď krv vyteká z poškodenej cievy. Fibrín, polymerizujúci, tvorí tenké vlákna, ktoré držia ... ... Prírodná veda. encyklopedický slovník
faktory zrážanlivosti krvi- Schéma interakcie koagulačných faktorov pri aktivácii hemokoagulácie Faktory zrážanlivosti krvi sú skupinou látok obsiahnutých v krvnej plazme a krvných doštičkách a poskytujú ... Wikipedia
zrážanie krvi- Zrážanie krvi (hemokoagulácia, súčasť hemostázy) je zložitý biologický proces tvorby fibrínových proteínových vlákien v krvi, tvoriacich krvné zrazeniny, v dôsledku čoho krv stráca svoju tekutosť a získava zrazenú konzistenciu. V dobrom stave ... ... Wikipedia