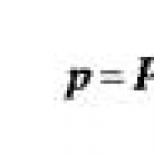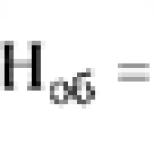Oral çocuk felci aşısının kullanım talimatları. Polio Aşısı için Bivouac Polio - Özellikleri ve Faydaları. Polio Aşısı: Yan Etkiler ve Sağlık Tehlikeleri
BiVac çocuk felci - çocuk felcinin önlenmesi için bir aşı; oral, canlı zayıflatılmış 1, 3 tip, bivalan (iki tip virüs içerir).
Serbest bırakma formu ve kompozisyon
BiVac Polio, oral uygulama için bir çözelti şeklinde üretilir: pembe-kırmızıdan sarı-kırmızıya, berrak bir sıvı, görünür yabancı inklüzyonlar ve tortu olmadan.
1 dozun bileşimi (4 damla - 0.2 ml):
- aktif madde: poliomyelit virüsü, Sabin tip 1'in zayıflatılmış suşları - en az 10 6.0 TCD 50 (doku sitopatojenik dozları) ve tip 3 - en az 10 5.5 TCD 50 IE (bulaşıcı birim) virüsün;
- ek bileşenler: magnezyum klorür, kanamisin.
Kullanım endikasyonları
BiVac çocuk felci çözümü, çocuk felcinin aktif olarak önlenmesi için tasarlanmıştır.
Kontrendikasyonlar
- oral çocuk felci aşısı ile önceki aşılama sırasında gözlenen nörolojik bozukluklar;
- birincil (doğuştan) immün yetmezlik durumları;
- şiddetli reaksiyon (40 ° C'nin üzerindeki sıcaklık dahil) veya önceki aşı uygulamasına ilişkin komplikasyonlar;
- malign neoplazmalar;
- akut hastalıklar (bulaşıcı veya bulaşıcı olmayan doğa), kronik hastalıkların alevlenmesi (aşıya tam iyileşme veya remisyondan sadece 2-4 hafta sonra izin verilir);
- immünosupresyon (tedavinin tamamlanmasından en geç 12 hafta sonra aşıya izin verilir);
- gebelik;
- aşı bileşenlerinden herhangi birine aşırı duyarlılık.
Emzirme sırasında ilacın güvenliği oluşturulmamıştır.
Uygulama yöntemi ve dozaj
BiVac Polio aşısı sadece ağızdan kullanım içindir!
İlaç, alım başına 0,2 ml (4 damla) aşı dozunda reçete edilir. Aşı, yemekten 1 saat önce flakon veya pipete takılı damlalık kullanılarak ağza verilir. İşlemden sonra 1 saat boyunca herhangi bir sıvıdan damla içmek veya içmek/yemek yemek yasaktır.
Çocuk felcine karşı birinci ve ikinci aşı olan çocuklara, IPV kullanma talimatına göre çocuk felcinin önlenmesi için inaktive çocuk felci aşısı (IPV) uygulanır.
Çocuklar için üçüncü aşılamanın yanı sıra çocuk felcine karşı sonraki yeniden aşılamalar, canlı oral çocuk felci aşısı (OPV) ile gerçekleştirilir.
Aşı kursu üç aşı içerir:
- I - 3 aylıkken IPV;
- II - 4,5 aylıkken IPV;
- III - 6 aylıkken PPV.
Yeniden aşılama, PPV tarafından üç aşamada gerçekleştirilir: 18 ayda, 20 ayda ve 14 yılda.
HIV bulaşmış annelerden doğan bebekler, HIV bulaşmış veya yetimhanelerde bulunan çocuklar üçüncü bir aşılama ve ardından IPV ile 3 tur çocuk felci güçlendirici aşı alırlar.
Bir çocuk için daha büyük yaşta rutin aşılama başlatılırsa, o zaman da belirlenen şemaya göre gerçekleştirilir (I ve II aşılama - IPV, III aşılama ve sonraki yeniden aşılamalar - PPV).
Salgın endikasyonlarına göre çocuk felcine karşı aşılama yapılırken PPV kullanılır.
Vahşi çocuk felci virüsünün neden olduğu çocuk felci gelişimi vakaları kaydedildiyse, ikincisi çevresel nesnelerden veya insan biyo-tahlillerinde izole edildiyse, aşağıdaki vatandaş kategorileri zorunlu tek aşılamaya tabidir (çocuk felci odağındaki temas kişi sayısına dahil edilmiştir veya Vahşi çocuk felci virüsünün neden olduğu da dahil olmak üzere bir lezyondan şüpheleniliyorsa):
- 3 aydan 18 yaşına kadar olan çocuklar;
- çocuk felcinin endemik olduğu ülkelerden/bölgelerden gelen 3 ay ila 15 yaş arası çocuklar (önceki aşılara ilişkin güvenilir verilerin yokluğunda, üçlü aşı önerilir);
- sağlık çalışanları;
- çocuk felci için endemik ülkelerden/bölgelerden gelenlerle temas halinde olan 3 aylıktan (yaş sınırı olmayan) kişiler;
- sabit bir ikamet yeri olmayan 3 ay ila 15 yaş arası çocuklar (önceki aşılara ilişkin güvenilir verilerin yokluğunda, üçlü aşı reçete edilir);
- Canlı çocuk felci virüsü veya istihdam sırasında potansiyel olarak vahşi çocuk felci virüsü bulaşmış malzemelerle çalışan yaş sınırlaması olmayan kişiler.
İlk üç aşı arasındaki sürenin azaltılmasına izin verilmez. İstisnai durumlarda, aşılar arasındaki sürenin uzatılması ancak sıkı kurallar varsa mümkündür. tıbbi kontrendikasyonlar.
İlk üç aşı arasındaki süre uzatılarak üçüncü ve dördüncü aşı arasındaki süre 3 aya indirilebilir.
Yan etkiler
BiVac Polio aşısının ardından ilk birkaç saat içinde ani alerjik reaksiyonlar meydana gelebilir.
İLE yan etkiler Kural olarak, ilacı aldıktan sonraki dördüncü ila otuzuncu gün arasında gelişebilen aşağıdakileri içerir:
- nadiren: spesifik olmayan semptomlar - baş ağrısı, kusma, ateş (aşı ile ilişkili olmayabilir);
- çok seyrek: alerjik reaksiyonlar (ürtiker, Quincke ödemi dahil);
- izole vakalar (aşılanmış kişilerde ve ayrıca onlarla temas halinde olan kişilerde kayıtlı): aşıya bağlı paralitik poliomyelit (VAPP); bu komplikasyonun gelişmesini önlemek için ilk iki aşı IPV ile yapılır.
Özel Talimatlar
BiVac Polio aşısı olacak tüm kişiler önce bir doktor (paramedik) tarafından muayene edilmelidir.
Gruptaki tüm çocuklara aynı anda çocuk kurumlarında çocuk felcine karşı aşı planlanması gerekmektedir.
Aşı virüsünün dolaşımını sınırlamak için aşılamadan sonra sıkı kişisel hijyen gereklidir. Aşılı çocuk ailedeki bağışıklığı yetersiz hastalardan izole edilmeli ve ayrıca kendisine ayrı bir yatak, lazımlık, nevresim ve giysi sağlanmalıdır.
Ailelerin hala aşılanmamış çocukları varsa (aşılama kontrendikasyonları veya yaş nedeniyle), hedef gruplardaki çocuklar IPV ile aşılanmalıdır.
Poliomyelite karşı aşıların, ilacın adını, parti numarasını, dozu, aşı tarihini ve buna tepkiyi gösteren yerleşik muhasebe formlarına kaydedilmesi zorunludur.
BiVac Polio, 2-8 ° C sıcaklıkta 48 saatten fazla olmamak üzere açılmış bir flakonda saklanabilirken, flakon lastik bir tıpa veya damlalık ile sıkıca kapatılmalıdır.
Şişenin bütünlüğünün ve etiketlenmesinin ihlali veya şeffaflığında, renginde veya diğer fiziksel özellikler ilaç kullanılmamalıdır.
Aşı sırasında veya hemen sonrasında ishal veya kusma meydana gelirse, ancak bu semptomlar düzeldikten sonra ikinci bir doz verilebilir.
Hafif akut solunum yolu formlarının varlığında viral enfeksiyonlar veya akut bağırsak hastalıkları, aşılama sıcaklığın normale dönmesinden sonra yapılmalıdır.
Hastanın planlı bir operasyon geçirmesi planlanıyorsa aşılama operasyondan en geç 30 gün önce yapılmalıdır. Operatör atanırken cerrahi müdahale aşı ameliyattan en geç 3-4 hafta sonra uygulanabilir.
var potansiyel bir tehdit solunum yetmezliği öyküsü olan çocuklarda veya prematüre bebeklerde (28 haftadan az) BiVac Polio kullanırken apne oluşumu. Sonuç olarak bu risk grubundaki çocuklarda sürekli takip edilmesi gerekmektedir. solunum aktivitesi ilacı aldıktan sonra 2-3 gün içinde.
ilaç etkileşimi
BiVac çocuk felcine adsorbe edilmiş difteri-difteri-tetanoz aşısı (DTP aşısı) veya adsorbe edilmiş difteri-tetanoz toksoid aşısı (DTP veya ADT-M toksoid) ile aynı gün izin verilir. Poliomyelit aşısı, Ulusal Bağışıklama Programının diğer müstahzarları ile eş zamanlı olarak da uygulanabilir.
İmmünosupresif ajanlar, çocuk felci aşısına karşı bağışıklık tepkisini azaltabilir, aşı virüslerini çoğaltabilir ve dışkıyla atılma sürelerini artırabilir.
analoglar
BiVac Polio'nun analogları şunlardır: Imovax Polio, Oral polio aşı tipleri 1, 2 ve 3, Poliorix, Polimileks.
Depolama şartları ve koşulları
-20 °C veya altındaki sıcaklıklarda çocukların erişemeyeceği yerlerde saklayın. Taşıma sırasında, 2 ila 8 °C arasındaki sıcaklık rejimine uyun, ardından olası müteakip tekrar -20 °C'ye dondurun.
Raf ömrü: -20°C ve altında - 24 ay, 2-8°C sıcaklıkta - 6 ay.
IMOVAX POLİO
(çocuk felci aşısı, inaktif)
Uluslararası tescilli olmayan isim
Dozaj formu
Bir şırıngada kas içi veya deri altı enjeksiyon için süspansiyon 0,5 ml / 1 doz No.
Kompozisyon
1 doz (0,5 ml) şunları içerir:
aktif maddeler:
poliovirüs* tip 1, Mahoney suşu (inaktive edilmiş)……40 D ünite antijen,
poliovirüs* tip 2 suşu MEF-1 (inaktive edilmiş)…… 8 D ünite antijen,
poliovirüs* tip 3, Saukett suşu (inaktive edilmiş)…… 32 D ünite antijen.
* Vero hücrelerinde kültürlendi
2-fenoksietanol 2.0 - 3.0 µl, formaldehit 2.0 - 20.0 µg, 199 Hanks ortamı (diğer bileşenlerin yanı sıra amino asitler, mineral tuzlar, vitaminler, glikoz, polisorbat 80 ve 0,5 ml'ye kadar enjeksiyon için su), pH'ı ayarlamak için hidroklorik asit veya sodyum hidroksit.
Tanım
Şeffaf renksiz sıvı.
farmakoterapötik grup
Çocuk felci aşıları.
Poliomyelitis virüsü - üç değerlikli inaktive. ATX kodu J07 BF 03
farmakolojik özellikler
farmakokinetik
Aşılar farmakokinetik değerlendirme gerektirmez
farmakodinamik
Aşı, Vero hücreleri üzerinde büyütülen, saflaştırılan ve formaldehit ile inaktive edilen poliovirüs tip l, 2 ve 3'ten yapılır.
Birincil aşılama sürecinden (üç doz) bir ay sonra, seroproteksiyon seviyesi tip 1 ve tip 3 poliovirüsler için -%100 ve tip 2 için %99'dan %100'e çıkmıştır.
4. rapel dozdan sonra, hastaların %94-99'unda koruyucu bir antikor titresi seviyesi ile bağışıklık en az 5 yıl korunur.
Kullanım endikasyonları
Bu aşı yeni doğanlarda, çocuklarda poliomyeliti önlemek için kullanılır. genç yaş ve yetişkinler, canlı zayıflatılmış çocuk felci aşısının kullanımına karşı kontrendikasyonları olanlar da dahil olmak üzere, birincil ve ikincil aşıların bir parçası olarak.
Dozaj ve uygulama
Birincil aşılama: 2 aylıktan başlayarak, sonraki dozlar arasında 1 ila 2 aylık bir aralıkla 0,5 ml'lik (1 doz) üç doz aşı uygulanır. İlk yeniden aşılama (1 takviye dozu), üçüncü birincil aşılama dozundan bir yıl sonra gerçekleştirilir.
Aşılanmamış yetişkinlere, her bir doz arasında 1 ay veya tercihen 2 ay aralıklarla 2 ardışık 0,5 ml (1 doz) enjeksiyon uygulanır. Yetişkinler için, ilk yeniden aşılama (1 takviye dozu), aşının 2. enjeksiyonundan 8 ila 12 ay sonra uygulanır. Çocuklarda ve adolesanlarda her 5 yılda bir ve yetişkinlerde her 10 yılda bir ilave rapel dozları önerilir.
kadarıyla Farklı ülkeler farklı aşılama çizelgeleri kullanın, bu çizelgeler ulusal tavsiyelerle uyumlu olmalıdır.
Herhangi bir nedenle IMOVAX POLIO bağışıklaması bir veya iki aşı ile sınırlı olan çocuklar için Ulusal Bağışıklama Çizelgesi tarafından belirlenen zamanlarda canlı atenüe aşı ile çocuk felcine karşı sonraki aşılar yapılabilir.
Giriş yöntemi.
Aşı intramüsküler veya subkutan olarak uygulanır.
Tercih edilen enjeksiyon bölgesi Intramüsküler enjeksiyon yenidoğanlarda ve küçük çocuklarda medial lateral uyluk ve çocuklarda, ergenlerde ve yetişkinlerde deltoid kastır.
Yan etkiler
hepsinin sıklığı ters tepkiler sırasında kayıtlı pratik uygulama son derece küçüktür ve toplam enjeksiyon sayısının %0.01'inden daha azdır.
Çocuklar için aşı takvimi göz önüne alındığında, IMOVAX POLIO nadiren tek başına verilir.
Yaygın advers reaksiyonlar:
Enjeksiyon bölgesinde şişme gibi reaksiyonlar aşılamadan sonraki 48 saat içinde ortaya çıkabilir ve bir ila iki gün sürebilir,
lenfadenopati.
ürtiker gibi aşı bileşenlerinden birine karşı tip I aşırı duyarlılık reaksiyonu, anjiyoödem, bir anafilaktik reaksiyon veya anafilaktik şok,
aşıdan sonraki birkaç gün içinde miyalji ve orta ve geçici artralji.
aşıdan sonraki birkaç gün içinde konvülsiyonlar (tek başına veya ateşle birlikte), baş ağrısı, orta ve geçici parestezi (özellikle alt uzuvlar) aşılamadan sonraki iki hafta içinde.
aşıdan sonraki ilk saatlerde veya günlerde kısa süreli heyecan, uyuşukluk ve sinirlilik.
çok prematüre bebekler (28 haftadan az) aşıdan sonraki 2-3 gün içinde kısa süreli apne yaşayabilir.
Kontrendikasyonlar
akut hastalıklar ve ateşin eşlik ettiği hastalıklar
alevlenme kronik hastalıklar
streptomisin, neomisin, polimiksin B'ye ve ayrıca aşıyı oluşturan diğer bileşenlere karşı aşırı duyarlılık.
İlaç etkileşimleri
IMOVAX POLIO, vücudun farklı bölgelerine farklı şırıngalar kullanılarak uygulanmak şartıyla diğer aşılarla aynı gün (aynı gün) kullanılabilir. istisna BCG aşısı Kazakistan Cumhuriyeti Sağlık Bakanı'nın 18 Şubat 2001 tarih ve 471 sayılı emri uyarınca diğer parenteral aşılarla aynı gün uygulanması yasak olan , "Tüberkülozla mücadeleyi güçlendirmek için devlet ve önlemler hakkında" Kazakistan Cumhuriyeti'nde"
Özel Talimatlar
Damar yatağına enjekte etmeyin, iğnenin kan damarına girmediğinden emin olun.
Bulanıksa aşıyı kullanmayın!
Herhangi bir enjekte edilebilir aşı gibi, IMOVAX POLYO da trombositopenisi veya kanaması olan hastalara dikkatle uygulanmalıdır, çünkü bu hastalarda intramüsküler uygulamadan sonra kanama olabilir.
Tüm enjekte edilebilir aşılarda olduğu gibi, (küçük de olsa) anafilaktik reaksiyon olasılığı vardır. Bu bağlamda, uygun olanın hazır bulundurulması gerekmektedir. ilaçlar ve aşının uygulanmasından sonra hastayı izlemek.
İmmün sistemi baskılanmış veya immünosupresif tedavi gören hastalarda aşıya verilen immün yanıt zayıflayabilir. Bu gibi durumlarda, tedavi tamamlanana veya ilgili hastanın bağışıklık koruma düzeyi doğrulanana kadar aşılamanın ileri bir tarihe ertelenmesi önerilir. Bununla birlikte, altta yatan hastalığa bağlı olarak bağışıklık tepkisinin olası sınırlamasına rağmen, kronik bağışıklık yetmezliği olan kişilerin (örneğin, HIV ile enfekte olanların) aşılanması önerilir.
IMOVAX POLIO, oral aşılama için kontrendike olan hastalarda da endikedir. Daha önce ağızdan aşı yaptırmış hastaların ikincil aşılarında da kullanılabilir.
Erken doğmuş bebeklerin (doğum ≤ 28 haftalık gebelik), özellikle solunum problemleri öyküsü varsa, birincil bağışıklama, potansiyel solunum zorluğu riskini ve solunum fonksiyonunu 48-72 saat izleme ihtiyacını hesaba katmalıdır. Bu yenidoğan grubunda aşılamanın faydaları yüksek olduğu için terk edilmemeli veya geciktirilmemelidir.
Hamilelik sırasında kullanın ve Emzirme
Bu aşı sadece hamilelik sırasında gerekirse yapılmalıdır.
Bu aşı emzirme döneminde yapılabilir.
aşırı doz
Veri yok.
Serbest bırakma formu ve paketleme
0,5 ml (1 doz) ilaç, bir şırıngada (tip I cam) bir piston strok sınırlayıcı (elastomerden yapılmış) ve koruyucu kapaklı bir iğne ile.
Polimer filmden yapılmış bir blister ambalajda 1 şırınga.
1 kontur paketi, eyalet ve Rus dillerinde kullanım talimatları ile birlikte bir karton paketin içine yerleştirilir.
Depolama koşulları
Işıktan korunan bir yerde buzdolabında (2 ºº ila 8 ºº sıcaklıkta) saklayın.
Dondurmayın.
Çocukların erişemeyeceği yerlerde saklayın.
Steril.
Raf ömrü
Son kullanma tarihinden sonra kullanmayınız.
Eczanelerden dağıtım şartları
Reçetede
Kayıt sertifikasının üreticisi ve sahibi:
Sanofi Pasteur S.A.
2, Avenue Pont Pasteur 69007
Lyon, Fransa
Kazakistan Cumhuriyeti topraklarındaki ürünlerin (malların) kalitesine ilişkin tüketici taleplerini kabul eden kuruluşun adresi
Filtrelenebilir Liste
Aktif madde:
Tıbbi kullanım talimatları
Oral çocuk felci aşısı türleri 1, 2 ve 3
için talimatlar tıbbi kullanım- RU No. R N000181/01
Son Değiştirilme Tarihi: 02.06.2015
Dozaj formu
Oral uygulama için çözüm.
Kompozisyon
İlaç bir aşı dozunda (0,1 ml - 2 damla) içerir:
Aktif madde:
Polio virüsü, Sabin'in zayıflatılmış suşları
1 tip - en az 10 6, 0 TCD 50
2 tip - en az 10 5.0 TCD 50
3 tip - en az 10 5.8 TCD 50
doku sitopatojenik dozlarda (TCD 50) ifade edilen virüsün bulaşıcı birimleri (IE).
Yardımcı maddeler:
Magnezyum klorür - 0.009 g - stabilizatör; kanamisin - 15 mcg - koruyucu.
Dozaj formunun açıklaması
Sarımsı-kırmızıdan pembe-kızıl renge kadar şeffaf sıvı, tortusuz, görünür yabancı kapanımlar olmadan.
karakteristik
Oral çocuk felci aşısı, Afrika yeşil maymun böbrek hücrelerinin birincil kültüründe veya bir sürekli Vero kültürü üzerinde bir geçişle Afrika yeşil maymun böbrek hücrelerinin birincil kültüründe büyütülen poliovirüs tip 1, 2, 3'ün atenüe Sabin suşlarından bir preparattır. Earl solüsyonunda %0.5 laktalbümin hidrolizatlı bir solüsyon formunda hücre hatları.
immünolojik özellikler
farmakolojik grup
MIBP - aşılar.
Belirteçler
Poliomyelitin aktif önlenmesi.
Kontrendikasyonlar
Kontrendikasyonlar şunlardır:
1. Oral çocuk felci aşısı ile önceki aşılama ile ilişkili nörolojik bozukluklar;
2. İmmün yetmezlik durumu (birincil), malign neoplazmalar, immünosupresyon (aşılar, tedavinin bitiminden en geç 6 ay sonra yapılır);
3. Planlı aşılama, hastalığın akut belirtilerinin ve kronik hastalıkların alevlenmesinin sonuna kadar ertelenir. Hafif SARS, akut bağırsak hastalıkları vb. ile sıcaklık normale döndükten hemen sonra aşılar yapılır.
Hamilelik ve emzirme döneminde kullanın
Hamile kadınlar ve emzirme dönemindeki kadınlar için aşının tıbbi kullanımının olasılığı ve özelliği araştırılmamıştır.
Dozaj ve uygulama
Dikkat: Aşı sadece oral uygulama.
Aşı doz başına 2 damla kullanılır. Aşının aşılama dozu, yemeklerden 1 saat önce flakona takılı bir damlalık veya pipet ile ağza verilir. Aşının su veya herhangi bir sıvı ile içilmesi, aşıdan sonraki bir saat içinde bir şeyler yiyip içilmesi yasaktır.
Olası bir aşı takvimi olarak, Rusya'daki çocuk felci aşı takvimi aşağıda gösterilmiştir.
Mevcut Ulusal Bağışıklama Çizelgesi uyarınca, çocuk felcine karşı birinci ve ikinci aşılar, IPV kullanım talimatlarına uygun olarak inaktive polio aşısı (IPV) ile gerçekleştirilir.
Çocuk felcine karşı üçüncü aşılama ve müteakip yeniden aşılamalar, Ulusal Bağışıklama Çizelgesi tarafından belirlenen yaşta oral çocuk felci aşısı (OPV) olan çocuklara yapılır.
İlk üç aşı, aşı kursunu oluşturur.
* HIV enfeksiyonu olan annelerden doğan çocuklar, HIV enfeksiyonu olan çocuklar, yetimhanelerdeki çocuklar - çocuk felcine karşı üçüncü aşılama ve müteakip yeniden aşılamalar, çocuk felcinin önlenmesi için inaktive edilmiş bir aşı olan IPV ile gerçekleştirilir.
İstisnai durumlarda aşı aralıklarının uzatılmasına izin verilir, tıbbi kontrendikasyonlar varsa, ilk üç aşı arasındaki aralıkların kısaltılmasına izin verilmez.
İlk üç aşı arasındaki aralık uzatılmışsa, üçüncü ve dördüncü aşılar arasındaki aralığın 3 aya düşürülmesine izin verilir.
Salgın belirtilerine göre çocuk felci aşısı oral çocuk felci aşısı ile yapılmaktadır.
Salgın belirtilerine göre aşılanacak kişilerin durumu, aşıların zamanlaması, prosedürü ve sıklığı, her özel durumda, ayrıntılar dikkate alınarak belirlenir. salgın süreççocuk felci ve salgın endikasyonlarına göre mevcut önleyici aşı takvimine göre:
Vahşi çocuk felci virüsünün neden olduğu (veya hastalıktan şüpheleniliyorsa) dahil olmak üzere, çocuk felci odaklarındaki temas kişileri:
- 3 aydan 18 yaşına kadar olan çocuklar - bir kez;
- sağlık çalışanları - bir kez;
- çocuk felci için endemik (olumsuz) ülkelerden (bölgelerden) 3 aydan 15 yaşına kadar gelen çocuklar - bir kez (önceki aşılar hakkında güvenilir veriler varsa) veya üç kez (mevcut değilse);
- sabit ikamet yeri olmayan kişiler (varsa) 3 aydan 15 yıla kadar - bir kez (önceki aşılar hakkında güvenilir veriler varsa) veya üç kez (eğer yoksa);
- çocuk felci için endemik (olumsuz) ülkelerden (bölgelerden) gelenlerle teması olan kişiler, 3 aylıktan yaş sınırlaması olmaksızın - bir kez;
- vahşi poliomyelit virüsü ile enfekte (potansiyel olarak enfekte) malzemelerle, yaş sınırı olmaksızın, canlı poliovirüs ile çalışan kişiler - bir kez işe alındıktan sonra.
Yan etkiler
Aşının girişindeki yan etkiler pratikte yoktur.
Bireysel olarak aşılanmış, yatkın alerjik reaksiyonlarÇok nadiren ürtiker veya Quincke ödemi gibi döküntü şeklinde alerjik komplikasyonlar görülebilir.
Aşıya bağlı paralitik poliomyelit (VAPP) oluşumu hem aşılı kişilerde hem de aşılı kişilerle temas halinde olan kişilerde son derece nadirdir.
Aşı virüsünün aşılı kişiler arasında dolaşımını sınırlamak için, aşı sonrası çocuğun kişisel hijyen kurallarına uyması gerektiği (ayrı yatak, lazımlık, nevresim, giysi ve aşılı çocuğu izole etme ihtiyacı) ebeveynlere anlatılmalıdır. ailede immün yetmezlik hastalarından).
aşırı doz
Doz aşımı istenmeyen sonuçlara yol açmaz.
Etkileşim
Çocuk felcine karşı aşıların, DTP aşısı (ADS- veya ADS-M toksoid) ile aşılama ile aynı gün yapılmasına izin verilir, çocuk felci aşısının Ulusal Aşı Programının diğer ilaçları ile eşzamanlı uygulanmasına izin verilir.
İhtiyati önlemler
Çocuklar için yaklaşan koruyucu aşıların günü hakkında ebeveynleri önceden bilgilendirmek gerekir.
Açılmış bir şişeden kullanılmamış bir aşı, bir damlalık veya kauçuk tıpa ile sıkıca kapatılmış bir şişede 2 ila 8 ° C sıcaklıkta 2 günden fazla saklanamaz. Gerekirse, asepsi kurallarına tabi olarak, lastik bir tıpa delinerek steril bir şırınga ile aşı çekilmesine izin verilir. Bu durumda flakonda kalan ve fiziksel özelliklerini değiştirmeyen aşı, son kullanma tarihi sonuna kadar kullanılabilir.
İlaç, bütünlük, etiketleme, fiziksel özellikleri (renk, şeffaflık vb.) değişiyorsa, son kullanma tarihi geçmişse, nakliye ve depolama koşulları ihlal edilmişse, flakonda kullanıma uygun değildir.
Poliomyelite karşı tüm aşılar, ilacın adını, aşı tarihini, dozunu, parti numarasını, aşıya verilen reaksiyonu gösteren yerleşik muhasebe formlarına kaydedilir.
Özel Talimatlar
Sürüş yeteneği için aşı Araçlar etkilemez.
Kronik hastalıkların alevlenmesi olan çocukların programlı aşılanması, tam iyileşene kadar ertelenir.
Salım formu
Bir şişe içinde 2.0 ml (20 doz). 10 flakon aşı ve kullanım talimatları bir karton kutu içerisine yerleştirilmiştir.
Depolama koşulları
SP 3.3.2.2329-08'e göre (SP 3.3.2.1248-03'teki değişiklikler ve eklemeler), aşı şu durumlarda saklanır: "soğuk zincirin" 1. seviyesinde - eksi 20 ° C ve altındaki bir sıcaklıkta, ne zaman aşının taşınması sıcaklık rejimi 2'den 8°C'ye kadar, ardından eksi 20°C'ye yeniden dondurulmasına izin verilir ("soğuk zincirin" 2. seviyesinde). Soğuk zincirin 3. ve 4. seviyelerinde aşı 2 ila 8°C sıcaklıkta saklanır.
Çocukların erişemeyeceği yerlerde saklayın.
Ulaşım koşulları
SP 3.3.2.2329-08 uyarınca 2 ila 8°C sıcaklıkta.
son kullanma tarihi
Eksi 20 °C ve altı - 2 yıl, 2 ila 8 °C - 6 ay arası bir sıcaklıkta.
ile aşı günü geçmiş kullanıma uygun değil.
Eczanelerden dağıtım şartları
Tedavi-ve-profilaktik ve sıhhi-profilaktik kurumlar için.
2006-11-24 tarihli R N000181/01
Oral çocuk felci aşısı 1, 2 ve 3 türleri - tıbbi kullanım talimatları - RU No.
1 doz (0,5 ml) şunları içerir:
Aktif içerik:
poliovirüs* tip 1, Mahoney suşu (inaktive edilmiş)……40 D ünite antijen,
poliovirüs* tip 2 suşu MEF-1 (inaktive edilmiş)…… 8 D ünite antijen,
poliovirüs* tip 3, Saukett suşu (inaktive edilmiş)…… 32 D ünite antijen.
* Vero hücrelerinde kültürlendi
Yardımcı maddeler:
2-fenoksietanol 2.0 - 3.0 µl, formaldehit 2.0 - 20.0 µg, 199 Hanks ortamı (diğer bileşenlerin yanı sıra amino asitler, mineral tuzlar, vitaminler, glikoz, polisorbat 80 ve 0,5 ml'ye kadar enjeksiyon için su içerir), hidroklorik asit veya sodyum pH'ı ayarlamak için hidroksit.
Tanım
Şeffaf renksiz sıvı.
farmakoterapötik grup
Çocuk felci aşıları.
Poliomyelitis virüsü - üç değerlikli inaktive.
ATX kodu J07 BF 03
farmakolojik özellikler"type="onay kutusu">
farmakolojik özellikler
farmakokinetik
Aşılar farmakokinetik değerlendirme gerektirmez
farmakodinamik
Aşı, Vero hücreleri üzerinde büyütülen, saflaştırılan ve formaldehit ile inaktive edilen poliovirüs tip l, 2 ve 3'ten yapılır.
Birincil aşılama sürecinden (üç doz) bir ay sonra, seroproteksiyon seviyesi tip 1 ve tip 3 poliovirüsler için -%100 ve tip 2 için %99'dan %100'e çıkmıştır.
4. rapel dozdan sonra, hastaların %94-99'unda koruyucu bir antikor titresi seviyesi ile bağışıklık en az 5 yıl korunur.
Kullanım endikasyonları
Bu aşı, canlı zayıflatılmış çocuk felci aşısının kullanımı için kontrendikasyonları olan bireyler de dahil olmak üzere, birincil ve ikincil aşılamanın bir parçası olarak yenidoğanlarda, küçük çocuklarda ve yetişkinlerde çocuk felcini önlemek için kullanılır.
Dozaj ve uygulama
Birincil aşılama: 2 aylıktan başlayarak, sonraki dozlar arasında 1 ila 2 aylık bir aralıkla 0,5 ml'lik (1 doz) üç doz aşı uygulanır. İlk yeniden aşılama (1 takviye dozu), üçüncü birincil aşılama dozundan bir yıl sonra gerçekleştirilir.
Aşılanmamış yetişkinlere, her bir doz arasında 1 ay veya tercihen 2 ay aralıklarla 2 ardışık 0,5 ml (1 doz) enjeksiyon uygulanır. Yetişkinler için, ilk yeniden aşılama (1 rapel doz), aşının 2. enjeksiyonundan 8-12 ay sonra uygulanır. Çocuklarda ve adolesanlarda her 5 yılda bir ve yetişkinlerde her 10 yılda bir ilave rapel dozları önerilir.
Farklı ülkeler farklı aşılama çizelgeleri kullandığından, bu çizelgeler ulusal tavsiyelerle uyumlu hale getirilmelidir.
Herhangi bir nedenle IMOVAX POLIO bağışıklaması bir veya iki aşı ile sınırlı olan çocuklar için Ulusal Bağışıklama Çizelgesi tarafından belirlenen zamanlarda canlı atenüe aşı ile çocuk felcine karşı sonraki aşılar yapılabilir.
Giriş yöntemi.
Aşı intramüsküler veya subkutan olarak uygulanır.
Kas içi enjeksiyon için tercih edilen bölge, yenidoğanlarda ve küçük çocuklarda orta yan uyluk ve çocuklarda, ergenlerde ve yetişkinlerde deltoid kastır.
Yan etkiler
Pratik kullanım sırasında kaydedilen tüm advers reaksiyonların sıklığı son derece düşüktür ve toplam enjeksiyon sayısının %0.01'inden daha azdır.
Çocuklar için aşı takvimi göz önüne alındığında, IMOVAX POLIO nadiren tek başına verilir.
Yaygın advers reaksiyonlar:
Şişme gibi enjeksiyon bölgesi reaksiyonları aşılamadan 48 saat sonra ortaya çıkabilir ve bir ila iki gün devam edebilir,
Lenfadenopati.
Ürtiker, anjiyoödem, anafilaktik reaksiyon veya anafilaktik şok gibi aşı bileşenlerinden birine karşı Tip I aşırı duyarlılık reaksiyonu,
Aşıdan sonraki birkaç gün içinde miyalji ve orta ve geçici artralji.
Aşıdan sonraki birkaç gün içinde konvülsiyonlar (tek başına veya ateşle birlikte), aşıdan sonraki iki hafta içinde baş ağrısı, orta ve geçici parestezi (esas olarak alt ekstremitelerde).
Aşıdan sonraki ilk saatlerde veya günlerde kısa süreli heyecan, uyuşukluk ve sinirlilik.
Çok erken doğmuş bebekler (28 haftadan az) aşılamadan sonraki 2-3 gün içinde kısa süreli apne yaşayabilir.
Kontrendikasyonlar
akut hastalıklar ve vücut sıcaklığındaki artışın eşlik ettiği hastalıklar
Kronik hastalıkların alevlenmesi
Streptomisin, neomisin, polimiksin B'ye ve ayrıca aşıyı oluşturan diğer bileşenlere karşı aşırı duyarlılık.
İlaç etkileşimleri"type="onay kutusu">
İlaç etkileşimleri
IMOVAX POLIO, vücudun farklı bölgelerine farklı şırıngalar kullanılarak uygulanmak şartıyla diğer aşılarla aynı gün (aynı gün) kullanılabilir. İstisna, 18 Şubat 2001 tarih ve 471 sayılı Kazakistan Cumhuriyeti Sağlık Bakanı'nın emri uyarınca diğer parenteral aşılarla aynı gün uygulanması yasak olan BCG aşısıdır. Kazakistan Cumhuriyeti'nde tüberkülozla mücadeleyi güçlendirmek"
Özel Talimatlar"type="onay kutusu">
Özel Talimatlar
Damar yatağına enjekte etmeyin, iğnenin kan damarına girmediğinden emin olun.
Bulanıksa aşıyı kullanmayın!
Herhangi bir enjekte edilebilir aşı gibi, IMOVAX POLYO da trombositopenisi veya kanaması olan hastalara dikkatle uygulanmalıdır, çünkü bu hastalarda intramüsküler uygulamadan sonra kanama olabilir.
Tüm enjekte edilebilir aşılarda olduğu gibi, (küçük de olsa) anafilaktik reaksiyon olasılığı vardır. Bu konuda uygun ilaçların hazır bulundurulması ve aşı yapıldıktan sonra hasta takibinin yapılması gerekmektedir.
İmmün sistemi baskılanmış veya immünosupresif tedavi gören hastalarda aşıya verilen immün yanıt zayıflayabilir. Bu gibi durumlarda, tedavi tamamlanana veya ilgili hastanın bağışıklık koruma düzeyi doğrulanana kadar aşılamanın ileri bir tarihe ertelenmesi önerilir. Bununla birlikte, altta yatan hastalığa bağlı olarak bağışıklık tepkisinin olası sınırlamasına rağmen, kronik bağışıklık yetmezliği olan kişilerin (örneğin, HIV ile enfekte olanların) aşılanması önerilir.
IMOVAX POLIO, oral aşılama için kontrendike olan hastalarda da endikedir. Daha önce ağızdan aşı yaptırmış hastaların ikincil aşılarında da kullanılabilir.
Erken doğmuş bebeklerin (doğum ≤ 28 haftalık gebelik), özellikle solunum problemleri öyküsü varsa, birincil bağışıklama, potansiyel solunum zorluğu riskini ve solunum fonksiyonunu 48-72 saat izleme ihtiyacını hesaba katmalıdır. Bu yenidoğan grubunda aşılamanın faydaları yüksek olduğu için terk edilmemeli veya geciktirilmemelidir.
Çocuk felci aşısı, oral
Oral çocuk felci aşısı tip 1, 2, 3 kullanımı için talimatlar
Dikkat: Aşı oral uygulama için tasarlanmıştır. Bu aşı hiçbir koşulda parenteral olarak uygulanmamalıdır.
Aşı, Afrika yeşil maymun böbrek hücrelerinin birincil kültüründe elde edilen poliovirüs tip 1,2,3'ün zayıflatılmış Sabin suşlarının üç değerlikli bir preparasyonudur. Magnezyum klorür stabilizatörü 1 dozda (0.2 ml) 0.018 g ve 1 dozda (0.1 ml) 0.009 g. Koruyucu kanamisindir, doz başına 30 mcg'den (0.2 mi) ve doz başına 15 mcg'den (0.1 mi) fazla değildir. Aşı sıvı halde, 2.0 ml (10 ve 20 doz) olarak üretilmiştir. İlaç, 1 aşı dozunda (0,2 ml veya 4 damla ve 0,1 ml veya 2 damla) bulaşıcı birimler içerir:
- tip 1 - en az 1.000.000
- tip 2 - en az 100.000
- tip 3 - en az 300.000
Aşı, tortu içermeyen, yabancı kapanımlar içermeyen kırmızımsı-turuncu renkli berrak bir sıvıdır.
Biyolojik ve immünobiyolojik özellikler
Aşı, aşılananların çoğunda (%90-95) poliovirüs tip 1, 2, 3'e karşı uzun süreli bağışıklık oluşturur.
Amaç
Poliomyelitin aktif önlenmesi. 3 ay ile 14 yaş arasındaki çocuklar rutin aşılara tabidir.
uygulama modu
Oral çocuk felci aşısı ile aşılar, önleyici aşı takvimi tarafından belirlenen yaşta 6 kez gerçekleştirilir (27 Haziran 2001 tarih ve 229 sayılı Rusya Sağlık Bakanlığı Kararı):
| aşılar | ||||||
| aşılama (IPV) | Yeniden aşılama (IPV) | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Yaş | 3 ay | 4,5 ay | 6 ay | 18 ay | 20 ay | 14 yaşında |
İstisnai durumlarda aşı aralıklarının uzatılmasına izin verilir, tıbbi kontrendikasyonlar varsa, ilk üç aşı arasındaki aralıkların kısaltılmasına izin verilmez.
İlk üç aşılama arasındaki aralıkların önemli ölçüde uzaması durumunda, üçüncü ve dördüncü aşılar arasındaki aralığın 3 aya düşürülmesine izin verilir. Bu bölgeye aşı belgesi olmadan gelen çocuklar üç aşıya tabidir. Bu çocukların sonraki aşıları yaşlarına uygun olarak yapılmaktadır.
Bir çocuk kurumunda, bir yerleşim biriminde çocuk felci hastalıklarının ortaya çıkması durumunda epidemiyolojik endikasyonlara göre aşılar yapılır.
Epidemiyolojik endikasyonlara göre bağışıklamaya tabi olan kişilerin durumu ve aşılama sıklığı, her bir özel durumda, çocuk felcinin salgın sürecinin özellikleri dikkate alınarak belirlenir. Daha sonra, çocuk felcine karşı bir sonraki programlanmış aşılar zamanında gerçekleştirilir.
Poliomyelite karşı aşıların aynı gün DTP aşısı (ADS- veya ADS-M toksoid) ile aşılama ile yapılmasına izin verilir, çocuk felci aşısının aşılama programının diğer ilaçları ile eşzamanlı uygulanmasına izin verilir.
Çocuklar, yaklaşan koruyucu aşıların günü hakkında ebeveynlerini önceden bilgilendirmelidir.
Aşı, ilacın ambalajına göre doz başına 4 veya 2 damla olarak kullanılır. Aşının aşılama dozu, yemeklerden 1 saat önce flakona takılı bir damlalık veya pipet ile ağza verilir. Aşının su veya herhangi bir sıvı ile içilmesi, aşıdan sonraki bir saat içinde bir şeyler yiyip içilmesi yasaktır. Açılmış bir şişeden kullanılmamış bir aşı, bir damlalık veya kauçuk tıpa ile sıkıca kapatılmış bir şişede (6 ± 2) ° C sıcaklıkta 2 günden fazla saklanamaz. Gerekirse, asepsi kurallarına tabi olarak, aşının steril bir şırınga ile kauçuk bir tıpa içinden çekilmesine izin verilir. Bu durumda flakonda kalan aşı son kullanma tarihine kadar kullanılabilir.
İlaç, bütünlüğü, etiketi bozulmuş, fiziksel özellikleri (renk, şeffaflık vb.) değişmişse, son kullanma tarihi geçmişse veya yanlış saklanmışsa flakonda kullanıma uygun değildir.
Poliomyelite karşı tüm aşılar, aşılama tarihini, dozu, üreticiyi, parti numarasını, aşıya tepkiyi gösteren yerleşik muhasebe formlarına kaydedilir.
Aşı tanıtımına tepki
Aşının tanıtımına pratikte hiçbir tepki yoktur.
Alerjik reaksiyonlara yatkın bazı aşılı kişilerde, ürtiker veya Quincke ödemi gibi döküntü şeklinde alerjik komplikasyonlar son derece nadirdir.
Aşıya bağlı hastalıklar, hem aşılı kişilerde hem de aşılı insanlarla temas halinde olan kişilerde son derece nadirdir ve her 3 milyon aşılı çocukta 1'den fazla değildir. Çocuk felci benzeri hastalıklarla her zaman ayırıcı tanı gerektirirler.
Aşı virüsünün aşılı çocuğun etrafındakiler arasında dolaşımını sınırlamak için, ebeveynlere aşı sonrası çocuğun kişisel hijyen kurallarına (ayrı yatak, lazımlık, nevresim, giysi vb. diğer çocuklardan ayrı) uymaları gerektiği anlatılmalıdır. ).
Kontrendikasyonlar
Canlı çocuk felci aşısı güvenli ve alantojeniktir. Kontrendikasyonlar şunlardır:
1. Daha önceki çocuk felci aşısına eşlik eden nörolojik bozukluklar;
2. İmmün yetmezlik durumu (birincil), malign neoplazmalar, immünosupresyon (aşılar, tedavinin bitiminden en geç 6 ay sonra yapılır);
3. Planlı aşılama, hastalığın akut belirtilerinin ve kronik hastalıkların alevlenmesinin sonuna kadar ertelenir. Hafif SARS, akut bağırsak hastalıkları vb. ile sıcaklık normale döndükten hemen sonra aşılar yapılır.
Salım formu.
Bir şişe içinde 2.0 ml (10 ve 20 doz).
Depolama koşulları
SP 3.3.2.028-95'e göre, eksi (20±1)°С'de özel düşük sıcaklıklı buzdolaplarında veya sıvı halde (6±2)°С'de dondurulur.
Aşının çözülmesi ve yeniden dondurulması kabul edilebilir, ancak tüm saklama süresi boyunca üç defadan fazla olamaz.
son kullanma tarihi
Eksi (20 ± 1) ° C - iki yıl, (6 ± 2) ° C - 6 ay sıcaklıkta. Son kullanma tarihi geçmiş ilaç kullanılmamalıdır.