Kimyasal özellikler. Glisin ve sodyum tuzu (E640) Amino asitlerin kimyasal özellikleri
Canlı organizmalarda önemli biyolojik işlevleri yerine getiren, protein biyosentezine katılan, sinir sisteminin normal aktivitesinden sorumludur ve metabolik süreçleri düzenler. Yapay olarak elde edilen aminoasetik asit ilaç, ilaç ve gıda endüstrisinde kullanılmaktadır.
Gıda katkı maddesi E640, ürünlerin tadını ve aromasını optimize etmek için kullanılan aminoasetik asit (glisin) ve onun sodyum tuzu bileşiklerini tek bir etiket numarası altında birleştirir. Ek, dünyanın çoğu ülkesinde güvenli ve resmi olarak onaylanmıştır.
Glisin ve sodyum tuzu: genel bilgi
Aminoasetik veya aminoetanoik asit olarak da bilinen glisin, proteinlerin ve bunların bileşiklerinin bir parçası olan en basit organik yapılar olan bir dizi esansiyel olmayan amino asitlere aittir. Yapay olarak elde edilen madde renksiz, kokusuz bir toz olup tatlımsı bir tada sahiptir.
Endüstriyel ölçekte glisin, kloroasetik asit ve amonyağın birleştirilmesiyle üretilir. Aminoasetik asit ise metal iyonlarıyla kompleks tuzlar (glisinatlar) oluşturma özelliğine sahiptir.
Sodyum glisinat, aynı zamanda sentetik kökenli bir madde olan sodyum ve aminoasetik asitin bir tuzudur. Glisin ve tuzu farklı kimyasal bileşikler olmasına rağmen gıda endüstrisinde tat ve aroma değiştiriciler olarak aynı işlevleri yerine getirirler, tek etiket numarası altında birleştirilirler ve E640 katkı maddesi olarak kabul edilirler.
| İsim | Glisin |
|---|---|
| Eş anlamlı | Aminoasetik (aminoetanoik) asit, glikokol (eski) |
| Grup | Esansiyel olmayan amino asitler |
| Kimyasal formül | NH2 – CH2 – COOH |
| Yapı | İnce monoklinik kristaller (kristal toz) |
| Renk | Beyaz (renksiz) |
| Koku | Mevcut olmayan |
| Tatmak | Tatlı |
| çözünürlük | Tamamen çözünür, kısmen çözünür. Eterde çözünmez |
| Katkı kodu | E640 (sodyum tuzu dahil) |
| Menşei | Sentetik |
| Toksisite | Normal sınırlar içerisinde tüketildiğinde güvenlidir |
| Kullanım alanları | Gıda endüstrisi, ilaç, ilaç, kozmetoloji |
Glisin ve kaynaklarının biyolojik rolü
Glisin, protein moleküllerinde diğer amino asitlerden çok daha sık bulunur ve önemli biyolojik işlevleri yerine getirir. İnsan vücudunda bu amino asit, glioksilatın transaminasyonu (amino grubunun tersinir transferi) veya kolin ve serinin enzimatik bölünmesi yoluyla sentezlenir.
Aminoasetik asit, biyosentezi canlı hücrelerde meydana gelen porfirinlerin ve pürinlerin öncüsüdür, ancak bu bileşiğin biyolojik rolü bu işlevlerle sınırlı değildir. Glisin ayrıca sinir uyarılarının iletilmesinde rol oynayan, diğer amino asitlerin üretimini düzenleyen ve nöronlar ve motor nöronlar üzerinde "inhibitör" etkisi olan bir nörotransmiterdir.
Sağlıklı bir kişinin vücudu, amino asitleri gerekli miktarlarda bağımsız olarak sentezler, bu nedenle kural olarak bunların ilaçlarda ve besin takviyelerinde kullanılmasına gerek yoktur. Aminoasetik asitin besin kaynakları arasında hayvansal ürünler (sığır karaciğeri), kabuklu yemişler ve bazı meyveler bulunur.
Glisin ve sodyum tuzunun insan vücudu üzerindeki etkisi
Bir nörotransmiter olarak aminoasetik asit, düzenleyici işlevleri yerine getirir ve öncelikle merkezi ve periferik sinir sistemini etkiler. Glisin nootropik özelliklere sahiptir, metabolizmayı normalleştirir, merkezi sinir sisteminin koruyucu fonksiyonlarını aktive eder ve hafif bir sakinleştirici etkiye sahiptir.
Glisin'in insan vücudu üzerindeki olumlu etkileri:
- duygusal gerilimin, kaygının, stresin, saldırganlığın azaltılması;
- geliştirilmiş ruh hali ve uykunun normalleşmesi;
- kasların gevşemesi ve krampların hafifletilmesi;
- artan performans;
- psikotrop ilaç almanın yan etkilerini azaltmak;
- bitkisel-vasküler bozuklukların ciddiyetinin azaltılması;
- alkol ve tatlı isteğini azaltır.
E640 takviyesinin bir parçası olan glisin ve tuzu yukarıdaki özelliklere sahip değildir ve normal sınırlar içerisinde tüketildiğinde insan vücudu üzerinde ne olumlu ne de olumsuz etkileri yoktur. Gıda katkı maddesi sağlık açısından tehdit oluşturmaz, ancak bireysel hoşgörüsüzlük durumunda alerjik reaksiyona neden olabilir.
Potansiyel tehlikeler, imalatında tat ve aroma iyileştiricilerin kullanıldığı katkı maddeleri ve düşük kaliteli gıda ürünlerindeki yabancı maddelerden kaynaklanabilir.
Glisin ve sodyum tuzunun uygulanması
Glisin ve sodyum glisinatın uygulamaları esas olarak gıda endüstrisi, ilaç ve farmasötiklerle sınırlıdır. Bununla birlikte aminoasetik asit, hipoalerjenitesi ve antioksidan etkisi nedeniyle kozmetik endüstrisinde de uygulama alanı bulmuştur.
E640 katkısını içeren kozmetikler:
- zayıflamış saçlar için ilaçlı şampuanlar ve kellik önleyici ürünler;
- tüm cilt tipleri için yaşlanma karşıtı kozmetikler, nemlendirici kremler ve maskeler;
- temizleme serumları ve tonerleri;
- rujlar ve balzamlar.
Ezilmiş glisin tabletleri ev yapımı cilt bakım ürünleri yapmak için kullanılabilir ve nemlendirici maske ve kremlere eklenebilir. Aminoasetik asit, değerli besin bileşenlerinin dermisin derin katmanlarına nüfuz etmesini teşvik eder ve tıbbi kozmetiklerin etkisini arttırır.
Gıda endüstrisinde katkı maddesi E640
 Glisin ve sodyum glisinat, alkollü içeceklerin üretimine yönelik teknolojik işlemlerde aktif olarak kullanılmaktadır. Özellikle elit votkada bulunan E640 katkı maddesi, hoş olmayan kokuyu nötralize etmeye ve sert tadı yumuşatmaya yardımcı olur. Alkollü içeceklerde glisinin varlığının, alkolün sinir sistemi üzerindeki toksik etkisini azaltmaya ve akşamdan kalmalığı önlemeye yardımcı olduğu yönünde bir görüş de vardır.
Glisin ve sodyum glisinat, alkollü içeceklerin üretimine yönelik teknolojik işlemlerde aktif olarak kullanılmaktadır. Özellikle elit votkada bulunan E640 katkı maddesi, hoş olmayan kokuyu nötralize etmeye ve sert tadı yumuşatmaya yardımcı olur. Alkollü içeceklerde glisinin varlığının, alkolün sinir sistemi üzerindeki toksik etkisini azaltmaya ve akşamdan kalmalığı önlemeye yardımcı olduğu yönünde bir görüş de vardır.
E640 katkısını içeren gıda ürünleri:
- güçlü alkollü içecekler;
- reçeller, konserveler, jöleler;
- posalı paketlenmiş meyve suları;
- zenginleştirilmiş pişirme;
- spor takviyeli içecekler;
- soslar, baharatlar ve baharatlar.
Aminoasetik asit, yalnızca biyolojik olarak aktif maddelerin tadını ve taşınmasını optimize etmek için değil, aynı zamanda antibakteriyel bir madde olarak da kullanılır. Özellikle tehlikeli E. coli'yi nötralize etmek amacıyla et, balık ve deniz ürünlerini tedavi etmek için kullanılır.
Tıbbi kullanım
Glisin, merkezi ve periferik sinir sistemi ile ilişkili hastalıkların tedavisinde ve önlenmesinde aktif olarak kullanılmaktadır. Bu madde, nootropik, sedatif, antikonvülsan ve hipnotik etkileri olan farmasötik preparatların bir parçasıdır ve hafif bir antidepresan ve sakinleştirici etkiye sahiptir.
Aminoasetik asidin ilaç olarak kullanımına ilişkin tıbbi endikasyonlar:
- zihinsel performansın azalması, uyku ve hafıza bozuklukları;
- duygusal gerginlik, stresli durumlar, nevrozlar;
- duygusal dengesizlik ve artan heyecanlanma;
- iskemik felç, travmatik beyin hasarı ve nöroenfeksiyonların sonuçları;
- bitkisel-vasküler distoni, iskemi;
- artan kas tonusu, kas krampları;
- alkol ve uyuşturucu bağımlılığı, ilaçların merkezi sinir sistemini baskılayan toksik etkileri.
Günde 3 gr glisin tüketmenin kişinin zihinsel yetenekleri ve genel duygusal durumu üzerinde olumlu etkisi olduğu, gün içindeki uyuşukluğu giderdiği ve gece uykusunu normalleştirdiği kanıtlanmıştır. İlaç ayrıca hamile kadınlara, sosyal uyum ve konsantrasyonda zorluk yaşayan çocuklara ve ergenlere kaygıyı azaltmak için reçete edilir.
Katkı maddesi E640 ve mevzuat
Tat ve koku iyileştirici E640 dünyanın çoğu ülkesinde gıda üretiminde kullanılıyor ancak Codex Alimentarius'ta katkı maddesine ilişkin bilgi bulunmuyor. Gıda olarak tüketildiğinde glisin ve sodyum glisinat zehirlenmesi vakası görülmemiştir, bu nedenle E640 değiştiricinin güvenli olduğu düşünülmektedir.
Katkı maddesi, Avrupa Birliği, ABD ve Kanada'da gıda endüstrisinde kullanım için resmi olarak onaylanmış ürünler listesinde yer almaktadır. Rusya Federasyonu ve Beyaz Rusya mevzuatı da SanPiN tarafından belirlenen izin verilen sınırlar dahilinde ürünlerde E640 bulunmasına izin vermektedir. Ukrayna'da E640'ın lezzet arttırıcı ve aroma maddesi olarak kullanımına ilişkin veri bulunmamaktadır.
Glisin ve tuzunun insan vücudu üzerinde toksik etkisi olmamasına ve kullanımı onaylanmış olmasına rağmen, E640 içeren ürünlere pek faydalı denilemez. Tatlandırıcıların ve aromaların çoğu, alıcının dikkatini, kullanımı en aza indirilmesi gereken düşük kaliteli ürünlere çekmek için kullanılır.
Proteinler, protein zincirinde yer alan amino asitlerin dizisine bağlı olan, belirli bir uzamsal yapıya sahip, oldukça büyük moleküler ağırlığa sahip polipeptitlerdir. Bu yapı kompakt (küresel proteinler) veya uzun (fibriler proteinler) olabilir. Tüm enzimler küresel proteinlerdir, fibriler proteinler arasında kollajen, keratin - cilt ve saç proteinleri bulunur, çok güçlü ve oldukça uzayabilir.
Bileşimlerine bağlı olarak proteinler, yalnızca amino asitlerden oluşan basit ve diğer sınıflardaki moleküllerle birlikte karmaşık kompleksler veya polipeptitlerin kovalent bileşiklerine ayrılır:
nükleik asitler – nükleoproteinler;
polisakaritler – glikoproteinler;
lipitler – lipoproteinler;
pigmentler – kromoproteinler;
fosforik asit kalıntıları - fosfoproteinler.
Karmaşık bir proteinin protein kısmına denir apobelcom, protein olmayan – prostetik grup. Hemen hemen tüm basit ve karmaşık küresel proteinler, canlı organizmalardaki biyokimyasal reaksiyonların biyolojik katalizörleri olan enzimlerdir.
Görevler
Görev 1. 0,001 mol amino asit nitröz asitle reaksiyona girdiğinde ne kadar gaz (normal koşullar altında) açığa çıkar: a) lösin; b) lizin; c) prolin?
Çözüm
Listelenen amino asitlerin nitröz asit ile reaksiyonlarının denklemlerini yazalım. Lösin ve lisin durumunda, Van Slyke'ye göre ve lizin için molekülde bulunan iki amino grubunda deaminasyon meydana gelir. Prolinin birincil bir amino grubu yoktur, dolayısıyla süreç N-nitrozasyon aşamasında durur.
(a) reaksiyonunda, lösin n(Leu)'nun mol sayısı, serbest kalan nitrojenin n(N2) mol sayısına eşittir, dolayısıyla 0,001 mol veya 22,4 ml nitrojen serbest bırakılır. Reaksiyonda (b) orijinal amino asit iki birincil amino grubuna sahip olduğundan, n(lys) ile karşılaştırıldığında iki kat miktarda gaz 2n(N2) oluşur; salınan nitrojenin hacmi 44,8 ml olacaktır. Reaksiyon (c)'de nitrojen salınmaz: prolin, 20 esansiyel amino asitten a-pozisyonunda ikincil bir nitrojen atomuna sahip olan tek üründür. Nitrolaştırıldığında, bir N-nitrozo (diazo yerine) bileşiği oluşur.
Cevap: a) 22,4 ml N2; b) 44,8 ml N2; c) N2 salınımı yoktur.
Görev 2. 9.36 mg bilinmeyen bir amino asit içeren bir çözeltinin, 748 mm Hg'de fazla miktarda nitröz asit ile işlenmesi sonucu. ve 20°C'de 2.01 ml nitrojen elde edildi. Bu amino asidin minimum molar kütlesi nedir?
Çözüm
Amino asitin nitröz asitle reaksiyonu:

Birleşik gaz yasasını kullanarak PV/T = yapı, normal koşullar altında nitrojen hacmini hesaplayalım (0 ° C veya 273 ° K sıcaklıkta ve 760 mm Hg basınçta): V 0 (N 2) (n.s.) = (P 1 · V 1 · T 0)/(P 0 ·T 1) = (748·2,01·273)/(760·293) = 1,84 ml.
Amino asit maddesinin mol sayısı ve gelişen gaz N2 aynı olduğundan orantıyı yapacağız:
9,36 mg amino asit, 1,84 ml N2 verir;
M (amino asidin moleküler ağırlığı) = 22,4 N2 verecektir.
M = (9,36·22,4)/1,84 = 114.
Valine olabilir: 
Görev 3. Hayvan hemoglobini %0,335 demir (ağırlıkça) içerir. Bu proteinin minimum molar kütlesi nedir? Ozmotik basınç ölçülerek belirlenen proteinin molekül ağırlığı 67.000 ise molekülde kaç demir atomu bulunur?
Çözüm
Hemoglobindeki demirin kütle oranı: C%(Fe) = /M(protein), burada n, protein molekülündeki Fe atomlarının sayısıdır. n = 1 olsun, o zaman M(protein)1 = M(Fe) %100/C%(Fe) = 56 100/0,335 = 16700. M(protein) kaynağının gerçek değeri (koşullara göre). = 67000, n = M kaynağı/M 1 = 67000/16700 = 4.
Görev 4. Aynı amino asit kalıntılarından oluşan 48 g dipeptit alkalin hidrolizi sırasında yalnızca bir madde oluştu - amino asidin sodyum tuzu. Bu tuzun kütlesi 66,6 g'dır. Dipeptit yapısını oluşturun.
Çözüm
Dipeptit alkalin hidrolizi için reaksiyon denklemi:
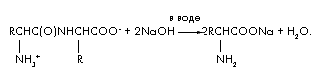
Dipeptit miktarını mol cinsinden (dipeptit) = x olarak gösterelim. Daha sonra hidroliz reaksiyonu iki kat fazla alkali (NaOH) = 2x tüketir ve (amino asitler) = 2x ve (H2O) = x üretir. m = ·M formülünü kullanarak bir malzeme dengesi denklemi oluşturalım;
m(dipeptid) + m(NaOH) = m(amino asit tuzları) + m(H20); 48 + 2x 40 = 66,6 + x 18; 62x = 18,6; x = 0,3 mol. M(dipeptid) = m/ = 48/0,3 = 160. M(amino asitler) = [M(dipeptid) + M(H20)]/2 = 178/2 = 89 g/mol. Amino asit alanindir. Dipeptit yapısı: ![]() .
.
Glisin (aminoasetik asit, glikokol, Gly, G)
H2NCH2COOH
Moleküler kütle 75.07; renksiz kristaller; erime 232-236°C (ayrışma ile); Suda oldukça çözünür, çoğu organik çözücüde çözünmez. 25°C p'de ka 2,34 (COOH) ve 9,6 (NH2); R BEN 5,97.
Kimyasal özellikler açısından glisin tipik bir alifatik a-amino asittir. Kantitatif belirleme, o-ftalaldehit ile renkli ürünlerin oluşumuna (Zimmermann reaksiyonu) dayanmaktadır. Proteinlerde diğer amino asitlerden daha sık bulunur. Porfirin bileşiklerinin ve pürin bazlarının biyosentezinde öncü olarak görev yapar. Glisin, gerekli olmayan kodlanmış bir amino asittir; biyosentezi, glioksilik asidin transaminasyonu, serin ve treoninin enzimatik bölünmesiyle gerçekleştirilir. Lizin, kloroasetik asit ve NH3'ten sentezlenir. D2O'daki NMR spektrumunda CH2 grubunun protonlarının kimyasal kayması 3,55 ppm'dir. Glisin (CH3)3 + NCH2COO'nun iç tuzuna betain denir.
Glisin, parenteral beslenme için diğer amino asitlerle karışım halinde tampon çözeltilerin bir bileşeni olarak peptitlerin sentezi için kullanılır.
Bu maddeyi içeren numunelerin kromatogramları
Amino asitlerin özellikleri kimyasal ve fiziksel olmak üzere iki gruba ayrılabilir.
Amino asitlerin kimyasal özellikleri
Bileşiklere bağlı olarak amino asitler farklı özellikler sergileyebilir.
Amino asit etkileşimleri:
Amino asitler amfoterik bileşikler olarak hem asitlerle hem de alkalilerle tuzlar oluştururlar.
Karboksilik asitler olarak amino asitler fonksiyonel türevler oluşturur: tuzlar, esterler, amidler.
Amino asitlerin etkileşimi ve özellikleri sebepler:
Tuzlar oluşur:
NH2 -CH2 -COOH + NaOH NH2 -CH2 -COONa + H2O
Sodyum tuzu + 2-aminoasetik asit Aminoasetik asitin (glisin) sodyum tuzu + su
İle etkileşimi alkoller:
Amino asitler, hidrojen klorür gazı varlığında alkollerle reaksiyona girebilir ve Ester. Amino asit esterleri bipolar yapıya sahip değildir ve uçucu bileşiklerdir.
NH2-CH2-COOH + CH3OH NH2-CH2-COOCH3 + H20.
Metil ester / 2-aminoasetik asit /
Etkileşim amonyak:
Amidler oluşur:
NH2-CH(R)-COOH + H-NH2 = NH2-CH(R)-CONH2 + H20
Amino asitlerin etkileşimi güçlü asitler:
Tuz alıyoruz:
HOOC-CH2-NH2 + HCl → Cl (veya HOOC-CH2-NH2 *HCl)
Bunlar amino asitlerin temel kimyasal özellikleridir.
Amino asitlerin fiziksel özellikleri
Amino asitlerin fiziksel özelliklerini sıralayalım:
- Renksiz
- Kristal bir forma sahip
- Amino asitlerin çoğu tatlı bir tada sahiptir ancak radikale (R) bağlı olarak acı veya tatsız olabilirler.
- Suda kolayca çözünür, ancak birçok organik çözücüde az çözünür
- Amino asitler optik aktivite özelliğine sahiptir
- 200°C'nin üzerindeki sıcaklıklarda bozunarak erir
- Uçucu olmayan
- Asidik ve alkali ortamlarda amino asitlerin sulu çözeltileri elektrik akımını iletir

Amino asitler, amino ve karboksil grupları içerir ve bu tür fonksiyonel gruplara sahip bileşiklerin tüm karakteristik özelliklerini sergiler. Amino asit reaksiyonları yazılırken iyonize olmayan amino ve karboksi gruplarının bulunduğu formüller kullanılır.
1) amino grubundaki reaksiyonlar. Amino asitlerdeki amino grubu, aminlerin olağan özelliklerini sergiler: aminler bazlardır ve reaksiyonlarda nükleofil görevi görürler.
1. Amino asitlerin bazlar halinde reaksiyonları. Amino asitler asitlerle etkileşime girdiğinde amonyum tuzları oluşur:
glisin hidroklorür, glisin hidroklorür tuzu
2. Azotlu asidin etkisi. Nitröz asit etki ettiğinde hidroksi asitler oluşur ve nitrojen ve su açığa çıkar:
Bu reaksiyon, proteinlerin yanı sıra amino asitlerdeki serbest amin gruplarının kantitatif tespiti için kullanılır.
3. N - asil türevlerinin oluşumu, asilasyon reaksiyonu.
Amino asitler anhidritler ve asit halojenürlerle reaksiyona girerek amino asitlerin N - asil türevlerini oluşturur:
Benzil eter sodyum tuzu N karbobenzoksiglisin - kloroformik glisin
Asilasyon, amino grubunu korumanın yollarından biridir. N-asil türevleri, serbest bir amino grubu oluşturmak üzere kolayca hidrolize edilebildiğinden, N-asil türevleri, peptitlerin sentezinde büyük öneme sahiptir.
4. Schiff bazlarının oluşumu. A-amino asitler aldehitlerle etkileşime girdiğinde, karbinolaminlerin oluşum aşamasında ikame edilmiş iminler (Schiff bazları) oluşur:
alanin formaldehit alaninin N-metilol türevi
5. Alkilasyon reaksiyonu. A-amino asitteki amino grubu, N-alkil türevlerini oluşturmak üzere alkile edilir:
2,4-dinitroflorobenzen ile reaksiyon çok önemlidir. Ortaya çıkan dinitrofenil türevleri (DNP türevleri), peptitlerin ve proteinlerin amino asit sekansının oluşturulmasında kullanılır. A-amino asitlerin 2,4-dinitroflorobenzen ile etkileşimi, benzen halkasındaki nükleofilik ikame reaksiyonunun bir örneğidir. Benzen halkasında iki güçlü elektron çekici grubun varlığı nedeniyle halojen hareketli hale gelir ve bir ikame reaksiyonuna girer:
 |
2.4 – dinitro –
florobenzen N - 2,4 - dinitrofenil - a - amino asit
(DNPB) DNP - a - amino asitlerin türevleri
6. Fenil izotiyosiyanat ile reaksiyon. Bu reaksiyon, peptidlerin yapısının belirlenmesinde yaygın olarak kullanılmaktadır. Fenil izotiyosiyanat, izotiyosiyanik asit H-N=C=S'nin bir türevidir. A-amino asitlerin fenil izotiyosiyanat ile etkileşimi, bir nükleofilik ekleme reaksiyonu mekanizması yoluyla ilerler. Ortaya çıkan ürün daha sonra molekül içi bir ikame reaksiyonuna girerek siklik ikame edilmiş bir amid: feniltiyohidantoin oluşumuna yol açar.
Siklik bileşikler niceliksel verimle elde edilir ve tiyohidantoin (PTH - türevleri) - amino asitlerin fenil türevleridir. PTG türevleri R radikalinin yapısında farklılık gösterir.
A-amino asitler, sıradan tuzlara ek olarak, belirli koşullar altında ağır metal katyonlarıyla kompleks içi tuzlar oluşturabilir. Tüm a-amino asitler, güzel kristalleşen, yoğun mavi renkli kompleks içi (şelat) bakır tuzlarıyla karakterize edilir:
Alanin etil ester
Ester oluşumu, peptid sentezinde karboksil grubunun korunmasına yönelik yöntemlerden biridir.
3. Asit halojenürlerin oluşumu. Sülfür oksidiklorür (tionil klorür) veya fosfor oksit triklorür (fosfor oksiklorür) ile korunan bir amino grubuna sahip a-amino asitler üzerinde etkili olduğunda asit klorürler oluşur:
Asit halojenürlerin üretimi, peptid sentezinde karboksil grubunu aktive etmenin yollarından biridir.
4.A-amino asit anhidritlerinin elde edilmesi. Asit halojenürler çok reaktiftir, bu da kullanıldığında reaksiyonun seçiciliğini azaltır. Bu nedenle, peptid sentezinde bir karboksil grubunu aktive etmek için daha yaygın olarak kullanılan bir yöntem, onu bir anhidrit grubuna dönüştürmektir. Anhidritler asit halojenürlerden daha az aktiftir. Korunan bir amino grubuna sahip bir a-amino asit, etil kloroformik asit (etil kloroformat) ile etkileşime girdiğinde bir anhidrit bağı oluşur:
5. Dekarboksilasyon. a - Aynı karbon atomunda iki elektron çekici gruba sahip amino asitler kolaylıkla dekarboksile edilir. Laboratuvar koşullarında bu, amino asitlerin baryum hidroksit ile ısıtılmasıyla gerçekleştirilir. Bu reaksiyon vücutta biyojenik aminlerin oluşumuyla birlikte dekarboksilaz enzimlerinin katılımıyla meydana gelir:
ninhidrin
Amino asitlerin ısıyla ilişkisi. A-amino asitler ısıtıldığında diketopiperazinler adı verilen siklik amidler oluşur:

Diketopiperazin
g - ve d - Amino asitler sudan kolayca ayrılır ve iç amidler, laktamlar oluşturmak üzere siklize olur:
g - laktam (bütirolaktam)
Amino ve karboksil gruplarının beş veya daha fazla karbon atomu ile ayrıldığı durumlarda ısıtıldığında bir su molekülünün elimine edilmesiyle polimer poliamid zincirlerinin oluşmasıyla polikondensasyon meydana gelir.





